题目内容
4.铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO═Fe(CO)5;除去CO的化学反应方程式为:[Cu(NH3)2]OOCCH3+CO+NH3═[Cu(NH3)3(CO)]OOCCH3.请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为N>O>C,Cu+原子的价电子排布式为[Ar]3d10.
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是分子晶体,Fe(CO)5在空气中燃烧后剩余的固体呈红棕色,相应的化学方程式为4Fe(CO)5+13O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3+20CO2.
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是sp2、sp3,用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有bd形成.
a.离子键 b.配位键 c.非极性键 d.δ键
(4)金属铜投入氨水或H2O2溶液中均无明显现象,但投入氨水与H2O2的混合溶液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子反应方程式为Cu+H2O2+4NH3?H2O═[Cu(NH3)4]2++2OH?+4H2O(或Cu+H2O2+4NH3═[Cu(NH3)4]2++2OH?).
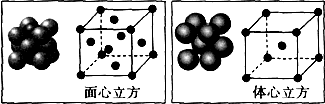
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,体心立方晶胞和面心立方晶胞中实际含有的铁原子个数之比为1:2,体心立方堆积与面心立方堆积的两种铁晶体的密度之比为3$\sqrt{3}$:4$\sqrt{2}$(写出已化简的比例式即可).
分析 (1)同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;Cu原子核外有29个电子,Cu原子失去最外层一个电子生成亚铜离子,根据构造原理书写亚铜离子核外电子排布式;
(2)分子晶体 的熔沸点较低;该物质在空气中燃烧生成红棕色固体是氧化铁,同时还生成二氧化碳;
(3)该配合物中C原子价层电子对个数有3个、4个的,根据价层电子对互斥理论判断C原子杂化方式;用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有配位键和δ键生成;
(4)Cu、H2O2和NH3?H2O反应生成铜氨络合离子、氢氧根离子和水;
(5)利用均摊法计算晶胞中Fe原子个数;根据密度公式ρ=$\frac{\frac{M}{{N}_{A}}×Fe原子个数}{V}$.
解答 解:(1)同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以C、N、O元素第一电离能大小顺序是N>O>C;Cu原子核外有29个电子,Cu原子失去最外层一个电子生成亚铜离子,根据构造原理书写亚铜离子核外电子排布式为[Ar]3d10,
故答案为:N>O>C;[Ar]3d10;
(2)分子晶体 的熔沸点较低,该物质熔沸点较低,属于分子晶体;该物质在空气中燃烧生成红棕色固体是氧化铁,同时还生成二氧化碳,方程式为4Fe(CO)5+13O2 $\frac{\underline{\;点燃\;}}{\;}$ 2Fe2O3+20CO2,
故答案为:分子晶体;4Fe(CO)5+13O2 $\frac{\underline{\;点燃\;}}{\;}$ 2Fe2O3+20CO2;
(3)该配合物中C原子价层电子对个数有3个、4个的,根据价层电子对互斥理论确定C原子杂化方式为sp3、sp2;用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有Cu原子和N、C原子之间的配位键且也是δ键生成,
故答案为:sp2、sp3;bd;
(4)Cu、H2O2和NH3?H2O反应生成铜氨络合离子、氢氧根离子和水,反应方程式为Cu+H2O2+4NH3?H2O═[Cu(NH3)4]2++2OH?+4H2O(或Cu+H2O2+4NH3═[Cu(NH3)4]2++2OH?),
故答案为:Cu+H2O2+4NH3?H2O═[Cu(NH3)4]2++2OH?+4H2O(或Cu+H2O2+4NH3═[Cu(NH3)4]2++2OH?);
(5)利用均摊法计算晶胞中Fe原子个数,体心立方晶胞中Fe原子个数=1+8×$\frac{1}{8}$=2、面心立方晶胞中Fe原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、,所以二者Fe原子个数之比=2:4=1:2;
设Fe原子半径为rcm,体心立方晶胞半径=$\frac{4\sqrt{3}}{3}$rcm,体积=($\frac{4\sqrt{3}}{3}$rcm)3,
面心立方晶胞半径=2$\sqrt{2}$rcm,其体积=(2$\sqrt{2}$rcm)3,
其密度之比=$\frac{\frac{M}{{N}_{A}}×2}{(\frac{4\sqrt{3}}{3}r)^{3}}$:$\frac{\frac{M}{{N}_{A}}×4}{(2\sqrt{2}r)^{3}}$=3$\sqrt{3}$:4$\sqrt{2}$,
故答案为:1:2;3$\sqrt{3}$:4$\sqrt{2}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、离子方程式书写、配合物、原子杂化方式判断等知识点,侧重考查学生分析、计算及空间想象能力,明确物质结构、物质性质是解本题关键,难点是晶胞计算,注意晶胞中哪些原子紧密连接,题目难度中等.

| A. | 盐酸 | B. | NaCl | C. | 水 | D. | 二硫化碳 |
| 金属 | Na | Cu | Al | Fe |
| 熔点/℃ | 97.5 | 1083 | 660 | 1535 |
| 沸点/℃ | 883 | 2595 | 2200 | 3000 |
| A. | Cu与Al | B. | Fe与Cu | C. | Fe与Na | D. | Al与Na |
①碳酸钠溶液与盐酸
②偏铝酸钠溶液与盐酸
③次氯酸钠溶液与CO2
④氯化铝溶液与氨水
⑤碳酸氢钠溶液与澄清的石灰水.
| A. | ③④ | B. | ①③⑤ | C. | 仅有⑤ | D. | ②④ |
| A. | 硫磺 | B. | 铁 | C. | 石墨 | D. | 氮气 |
| A. | 112号元素是金属元素 | |
| B. | 112号元素位于第七周期,是主族元素 | |
| C. | ${\;}_{112}^{277}$R原子中子数为165 | |
| D. | 112号元素为放射性元素 |
 请完成下列各题
请完成下列各题