题目内容
14.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛,请回答下列问题: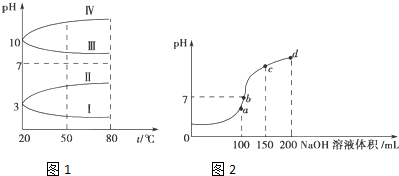
(1)相同条件下,pH相同的NH4Al(SO4)2中c(NH4+)>(填“=”、“>”或“<”)NH4HSO4中c(NH4+).
(2)如图1是0.1mol•L-1电解质溶液的pH随温度变化的图象.
①其中符合0.1mol•L-1NH4Al(SO4)2的pH随温度变化的曲线是A (填写字母);
②室温时,0.1mol•L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=10-3 mol•L-1(填数值)
(3)室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示.
试分析图中a、b、c、d四个点,水的电离程度最大的是a;在c点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)>c(H+).
分析 (1)NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解;
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大;
②根据电荷守恒定律解题;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离,c点溶液呈碱性,据此分析.
解答 解:(1)NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比NH4Al(SO4)2中的小,
故答案为:>;
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为A,
故答案为:A;
②根据电荷守恒,可以求出2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol•L-1[c(OH-)太小,可忽略],
故答案为:10-3;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离,c点溶液呈碱性,c(OH-)>c(H+),溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,a点时c(Na+)=c(SO42-),c点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)>c(H+),
故答案为:a;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)>c(H+).
点评 本题考查盐类的水解和离子浓度大小的比较,题目难度中等,(3)②为易错点,注意根据守恒思想解题.

| A. | 煤的干馏是物理变化 | |
| B. | 煤的气化和液化主要目的是为了获得较洁净的能源 | |
| C. | 汽油主要来自石油的裂解 | |
| D. | 乙烯是来自石油的裂化和裂解的重要化工原料 |
| A. | 124g P4含有的P-P键的个数为3NA | |
| B. | 18g冰晶体中含有的氢键的个数为4NA | |
| C. | 12g金刚石中含有的C-C键的个数为4NA | |
| D. | 60gSiO2中含Si-O键的个数为4NA |
| A. | 乙醇 | B. | 甲酸丙酯 | C. | 溴乙烷 | D. | 乙醛 |
(1)加入铝粉产生H2,说明铝具有还原性(填“氧化性”或“还原性”).
(2)甲同学分析:若H+大量存在,则NO3-就不能大量存在.设计实验证实如表:
| 装 置 | 现 象 |
 | Ⅰ.实验初始,未见明显现象 |
| Ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 | |
| Ⅲ.试管变热,溶液沸腾 |
②根据现象Ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
b.实验1、2说明反应生成了NO,写出该反应的离子方程式:Al+NO3?+4H+═Al3++NO↑+2H2O.
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在.重新设计实验证实如表:
| 装置 | 现象 |
 | Ⅰ.实验初始,未见明显现象 |
| Ⅱ.过一会儿,出现气泡,有刺激性气味 |
①刺激性气味的气体是NH3.
②产生该气体的离子方程是8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-.
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成.实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物.因此无色溶液一定能大量存在的是K+、OH-.
| A. | MgCl2的摩尔质量为95g | |
| B. | 常温常压下,1molCO2的质量是44g | |
| C. | 标准状况下,1molH2O所占体积约为22.4L | |
| D. | 100mL 1mol/L的稀硫酸中含有H+的数目约为6.02×10 22 |
 的同分异构体甚多,其中属于酯类化合物而且结构中有苯环结构的同分异构体就有6种,它们是:
的同分异构体甚多,其中属于酯类化合物而且结构中有苯环结构的同分异构体就有6种,它们是:


 .
.