题目内容
14.称取0.3280g H2C2O4•2H2O滴定NaOH溶液,消耗NaOH溶液25.78mL,求c(NaOH)为多少?分析 n(H2C2O4•2H2O)=$\frac{0.3280g}{126g/mol}$=0.0026mol,该反应方程式为H2C2O4+2NaOH=Na2C2O4+2H2O,根据草酸晶体和NaOH之间的关系式计算c(NaOH).
解答 解:n(H2C2O4•2H2O)=$\frac{0.3280g}{126g/mol}$=0.0026mol,该反应方程式为H2C2O4+2NaOH=Na2C2O4+2 H2O,
设c(NaOH)=xmol/L,
H2C2O4+2NaOH=Na2C2O4+2 H2O
1mol 2mol
0.0026mol 0.02578xmol
x=$\frac{0.0026mol×2mol}{1mol×0.02578mol}$=0.2019,
答:c(NaOH)为0.2019mol/L.
点评 本题以物质的量浓度计算为载体考查方程式的计算,为高频考点,明确各个物理量之间的关系式是解本题关键,注意有效数字的处理,题目难度不大.

练习册系列答案
相关题目
5.如图是a、b两种固体物质(不含结晶水)的溶解度曲线.下列说法正确的是( )
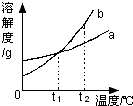

| A. | b的溶解度大于a的溶解度 | |
| B. | t1℃时,将a、b两种物质的饱和溶液分别恒温蒸发等质量的水,析出晶体的质量一定相等 | |
| C. | 将t2℃时的b的不饱和溶液降温至t1℃,一定能得到b的饱和溶液 | |
| D. | t2℃时,a溶液的溶质质量分数一定小于b溶液的溶质质量分数 |
2.下列物质中属于天然高分子化合物的是 ( )
①葡萄糖 ②蔗糖 ③果糖 ④淀粉⑤纤维素.
①葡萄糖 ②蔗糖 ③果糖 ④淀粉⑤纤维素.
| A. | ①②③ | B. | ④⑤ | C. | ②⑤ | D. | ①②③⑤ |
6.在一定温度下的定容密闭容器中,发生反应:A(g)+2B(g)?3C(g).当下列物理量不再变化时,不能表明反应已达平衡的是( )
| A. | 混合气体的压强 | B. | A的浓度不再变化 | ||
| C. | 正逆反应速率相等 | D. | C的质量不再变化 |
5.下列说法正确的是( )
| A. | 煤的干馏是物理变化 | |
| B. | 煤的气化和液化主要目的是为了获得较洁净的能源 | |
| C. | 汽油主要来自石油的裂解 | |
| D. | 乙烯是来自石油的裂化和裂解的重要化工原料 |