题目内容
从物质X出发有如图所示的一系列变化.已知X为酸式盐,A、C为无色气体,反应的某些产物已经略去.
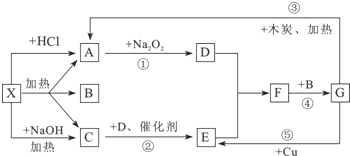
(1)写出下列物质的化学式:X: ;G: .
(2)写出反应②的化学方程式: .
(3)向X的溶液中加入过量的NaOH溶液,并加热,写出该反应的离子方程式: .
(4)反应④中氧化剂与还原剂的质量之比为 .

(1)写出下列物质的化学式:X:
(2)写出反应②的化学方程式:
(3)向X的溶液中加入过量的NaOH溶液,并加热,写出该反应的离子方程式:
(4)反应④中氧化剂与还原剂的质量之比为
考点:无机物的推断,含氮物质的综合应用
专题:推断题,氮族元素
分析:X为酸式盐,A、C为无色气体,结合图中反应①②可知,C应为NH3,D为O2,E为NO,F为NO2,则B应为H2O,G为HNO3,A可与Na2O2反应生成O2,则A应为CO2,X可能为NH4HCO3,结合相关物质的性质解答该题.
解答:
解:X为酸式盐,A、C为无色气体,结合图中反应①②可知,C应为NH3,D为O2,E为NO,F为NO2,则B应为H2O,G为HNO3,A可与Na2O2反应生成O2,则A应为CO2,X可能为NH4HCO3,
(1)由以上分析可知X可能为NH4HCO3,G为HNO3,故答案为:NH4HCO3;HNO3;
(2)反应②的化学方程式为4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O;
(3)向X的溶液中加入过量的NaOH溶液,并加热,该反应的离子方程式为NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O,故答案为:NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O;
(4)反应④为3NO2+H2O=2HNO3+NO,NO2既是氧化剂又是还原剂,由N原子守恒可知,氧化剂与还原剂的质量比为1:2,故答案为:1:2.
(1)由以上分析可知X可能为NH4HCO3,G为HNO3,故答案为:NH4HCO3;HNO3;
(2)反应②的化学方程式为4NH3+5O2
| ||
| △ |
| ||
| △ |
(3)向X的溶液中加入过量的NaOH溶液,并加热,该反应的离子方程式为NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O,故答案为:NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O;
(4)反应④为3NO2+H2O=2HNO3+NO,NO2既是氧化剂又是还原剂,由N原子守恒可知,氧化剂与还原剂的质量比为1:2,故答案为:1:2.
点评:本题考查无机物的推断,题目难度不大,本题注意酸性盐与酸、碱反应结合反应①②为突破口进行解答,注意相关物质的性质,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
下列各组离子中能大量共存的是( )
| A、K+、SiO32-、OH-、Na+ |
| B、Na+、H+、CO32-、SO42- |
| C、K+、H+、SiO32-、Cl- |
| D、OH-、Na+、HCO3-、Cl- |
下列关于氧化还原反应的说法中不正确的是( )
| A、氧化还原反应的本质是电子的转移(得失或偏移) |
| B、金属阳离子被还原一定得到金属单质 |
| C、凡有元素化合价升降的反应都是氧化还原反应 |
| D、还原剂在反应中失去电子,化合价升高,被氧化 |
下列说法中正确的是( )
| A、1molH2O中约含有6.02×1023个H |
| B、1molCH4的体积约为22.4L |
| C、CO2的摩尔质量为44g |
| D、1molNaOH质量是40g |
把SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀.在上述一系列变化过程中,最终被还原的是( )
| A、SO2 |
| B、Cl- |
| C、Fe3+ |
| D、NO3- |