题目内容
15.下列各组离子在溶液中能大量共存的是( )| A. | Ca2+,HCO3-,Cl-,K+ | B. | K+,SO32-,ClO-,Na+ | ||
| C. | Fe2+,H+,SO42-,NO3- | D. | Fe3+,SCN-,Na+,CO32- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应、相互促进水解、结合生成络离子等,则离子大量共存,以此来解答.
解答 解:A.该组离子之间不反应,可大量共存,故A正确;
B.SO32-、ClO-发生氧化还原反应,不能大量共存,故B错误;
C.Fe2+、H+、NO3-发生氧化还原反应,不能大量共存,故C错误;
D.Fe3+、SCN-结合生成络离子,Fe3+、CO32-相互促进水解,不能大量共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应及水解反应的判断,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
5.实验室制备Al(OH)3最好选用的试剂是( )
| A. | Al2O3和稀盐酸 | B. | Al2O3和水 | C. | Al2(SO4)3和NaOH | D. | AlCl3和氨水 |
3.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 1L 0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23 g钠充分燃烧时转移电子数为1NA | |
| D. | 密闭容器中2mol NO与1molO2充分反应,产物的分子数为2NA |
10.下列叙述中正确的是( )
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 当各轨道处于全满.半满.全空时原子较稳定 | |
| D. | 同一周期中,碱金属元素的第一电离能最大 |
20.下列物质的转化在指定条件下能实现的是( )
| A. | Cu$\stackrel{O_{2},CO_{2},H_{2}O}{→}$Cu2(OH)2CO3$\stackrel{△}{→}$Cu(OH)2 | |
| B. | MgO$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{加热,HCl氛围}{→}$MgCl2(s) | |
| C. | CaCl2(aq)$\stackrel{CO_{2}}{→}$CaCO3$\stackrel{SiO_{2}/高温}{→}$CaSiO3 | |
| D. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
7.下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
| A. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1molHCl气体中的粒子数与0.5mol/L盐酸中溶质粒子数相等 | |
| C. | 22.4L的CO气体与1molN2所含的电子数相等 | |
| D. | 任何条件下,16gCH4与18gH2O所含有电子数均为10NA |
5.A、B、C为三种短周期元素,A,B同周期,A、C的最低价离子分别为A2-、C-、B2+与C-具有相同的电子层结构,下列叙述一定不正确的是( )
| A. | 离子半径A2->C->B2+ | B. | 它们的原子半径C>B>A | ||
| C. | 它们的原子序数A>B>C | D. | 原子最外层上的电子数C>A>B |
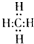 ,分子里各原子的空间分布呈正四面体结构.相对分子质量为212的烷烃的分子式为C15H32.分子式为C8Hm的烯烃,m值等于16;分子式为CnH8的苯的同系物,n值等于7.
,分子里各原子的空间分布呈正四面体结构.相对分子质量为212的烷烃的分子式为C15H32.分子式为C8Hm的烯烃,m值等于16;分子式为CnH8的苯的同系物,n值等于7.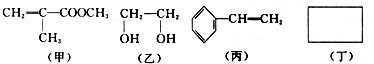
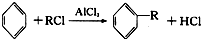 (-R为烃基)
(-R为烃基)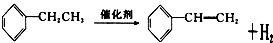
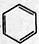 +CH3CH2Cl
+CH3CH2Cl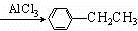 +HCl.
+HCl.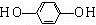 .
.