题目内容
20.下列物质的转化在指定条件下能实现的是( )| A. | Cu$\stackrel{O_{2},CO_{2},H_{2}O}{→}$Cu2(OH)2CO3$\stackrel{△}{→}$Cu(OH)2 | |
| B. | MgO$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{加热,HCl氛围}{→}$MgCl2(s) | |
| C. | CaCl2(aq)$\stackrel{CO_{2}}{→}$CaCO3$\stackrel{SiO_{2}/高温}{→}$CaSiO3 | |
| D. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
分析 A.Cu与空气中的氧气和水以及二氧化碳反应生成铜绿,铜绿失水变成氧化铜;
B.MgO与HCl反应生成MgCl2溶液,HCl能抑制镁离子的水解;
C.二氧化碳与氯化钙溶液不反应;
D.S在氧气中燃烧生成二氧化硫.
解答 解:A.Cu与空气中的氧气和水以及二氧化碳反应生成铜绿,铜绿加热分解生成二氧化碳、水和氧化铜,故A错误;
B.MgO与HCl反应生成MgCl2溶液,HCl能抑制镁离子的水解,所以在HCl气氛中加热MgCl2溶液,可以得到MgCl2固体,故B正确;
C.二氧化碳与氯化钙溶液不反应,所以向CaCl2溶液中通入CO2没有CaCO3生成,故C错误;
D.S在氧气中燃烧生成二氧化硫,二氧化硫与氧气在加热和催化剂条件下反应生成SO3,故D错误;
故选B.
点评 本题主要考查的是盐类水解的应用、化学反应原理、氧化还原反应等,题目综合性较强,侧重于考查学生对基础知识的应用能力,题目难度中等.

练习册系列答案
相关题目
10.实验探究是体验知识的产生和形成过程的基本途径.下面是某同学完成的探究实验报告的一部分:
实验名称:卤素单质的氧化性强弱比较
实验药品:NaBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸 请回答:
(1)完成该实验需用到的实验仪器是试管、胶头滴管.
(2)②中反应的化学方程式为2NaBr+Cl2=2NaCl+Br2.③中反应的离子方程式为2I-+Cl2=2Cl-+I2.
(3)CCl4在实验中所起的作用是萃取剂.
(4)该同学的实验设计不足之是没有比较Br2和I2的氧化性强弱,改进的办法是把第③步改为:将溴水滴在KI淀粉试纸上,观察试纸是否变蓝色(或KI溶液+溴水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色).(填相应的实验步骤)
实验名称:卤素单质的氧化性强弱比较
| 实验步骤 | 实验结论 |
| ①氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 |
(1)完成该实验需用到的实验仪器是试管、胶头滴管.
(2)②中反应的化学方程式为2NaBr+Cl2=2NaCl+Br2.③中反应的离子方程式为2I-+Cl2=2Cl-+I2.
(3)CCl4在实验中所起的作用是萃取剂.
(4)该同学的实验设计不足之是没有比较Br2和I2的氧化性强弱,改进的办法是把第③步改为:将溴水滴在KI淀粉试纸上,观察试纸是否变蓝色(或KI溶液+溴水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色).(填相应的实验步骤)
11.下列有关原子结构和化学用语中,对电子运动状态描述最详尽的是( )
| A. | ${\;}_{8}^{16}$O | B. |  | C. | 1s22s22p4 | D. |  |
15.下列各组离子在溶液中能大量共存的是( )
| A. | Ca2+,HCO3-,Cl-,K+ | B. | K+,SO32-,ClO-,Na+ | ||
| C. | Fe2+,H+,SO42-,NO3- | D. | Fe3+,SCN-,Na+,CO32- |
5.肉桂酸异戊酯是一种香料,其结构简式如图.下列有关肉桂酸异戊酯的叙述正确的是( )
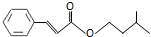

| A. | 不能使溴的四氯化碳溶液褪色 | |
| B. | 能与新制的Cu(OH)2共热生成红色沉淀 | |
| C. | 能与热的浓硝酸和浓硫酸混合液反应 | |
| D. | 能与FeCl3溶液反应显紫色 |
12.下列叙述不正确的是( )
| A. | c(NH4+)相等的NH4HCO3溶液、(NH4)2Fe(SO4)2溶液和(NH4)2SO4溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4HCO3) | |
| B. | 常温下,0.1 mol•L-1HCl溶液与等体积0.1 mol•L-1Ba(OH)2溶液混合后,溶液的pH=13 | |
| C. | 常温下,由水电离产生的c(H+)=10-13 mol•L-1的溶液,Fe2+、NO3-、Cl-、SO42-一定不能大量共存 | |
| D. | 0.1 mol•L-1的NaHCO3溶液中,c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |
9.某学生做如下实验:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失.下列叙述中对实验原理的解释和结论不正确的是( )
| A. | 氧化性:HClO>I2>SO42- | |
| B. | 淀粉KI溶液变蓝是因为I-被氧化为I2,淀粉遇I2变蓝 | |
| C. | 第二步蓝色消失的反应中1mol氧化剂失去电子的数目为2NA | |
| D. | 若将Na2SO3溶液加入氯水中,氯水褪色 |


 ;F→G:
;F→G: .
. .
.