题目内容
3.NA代表阿伏加德罗常数的值,下列叙述正确的是( )| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 1L 0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23 g钠充分燃烧时转移电子数为1NA | |
| D. | 密闭容器中2mol NO与1molO2充分反应,产物的分子数为2NA |
分析 A.n(CH3CH2CH2OH)=$\frac{60g}{60g/mol}$=1mol,每个丙醇分子中含有11个共价键;
B.碳酸氢钠溶液中存在了守恒n(Na)=n(C),碳元素所有存在形式和钠物质的量相同;
C.钠发生氧化反应后,Na元素的化合价由0升高为+1价;
D.NO2和N2O4之间存在转化,方程式2NO2?N2O4.
解答 解:A.n(CH3CH2CH2OH)=$\frac{60g}{60g/mol}$=1mol,每个丙醇分子中含有11个共价键,则60g丙醇中存在的共价键的物质的量为11mol,总数为11NA,故A错误;
B.碳酸氢钠溶液中存在了守恒n(Na)=n(C),碳元素所有存在形式和钠物质的量相同,1L 0.1mol/L的NaHCO3溶液中H2CO3、HCO3-和CO32-离子数之和为0.1NA,故B错误;
C.23g钠充分燃烧时转移电子数为$\frac{23g}{23g/mol}$×(1-0)×NA=1NA,故C正确;
D.NO和O2反应方程式为2NO+O2=2NO2,根据方程式知,2molNO与1molO2恰好完全反应生成2molNO2,但NO2和N2O4之间存在转化,方程式2NO2?N2O4,所以产物分子数小于2NA,故D错误;
故选C.
点评 本题考查阿伏伽德罗常数及计算,为高频考点,把握物质中的化学键、氧化还原反应中转移电子计算等为解答的关键,侧重分析与应用能力的综合考查,题目难度不大.

练习册系列答案
相关题目
14.将7.8g镁铝合金加入100mL 5.0mol•L-1NaOH溶液中,充分反应后收集到6.72L气体(标准状况),过滤得到溶液X.下列说法正确的是( )
| A. | 产生气体的质量为0.3g | |
| B. | 合金中镁与铝的物质的量之比为1:2 | |
| C. | 溶液X中剩余NaOH的物质的量为0.2 mol | |
| D. | 向溶液X中通入足量C02,过滤,将沉淀充分灼烧得固体15.6 g |
11.下列有关原子结构和化学用语中,对电子运动状态描述最详尽的是( )
| A. | ${\;}_{8}^{16}$O | B. |  | C. | 1s22s22p4 | D. |  |
15.下列各组离子在溶液中能大量共存的是( )
| A. | Ca2+,HCO3-,Cl-,K+ | B. | K+,SO32-,ClO-,Na+ | ||
| C. | Fe2+,H+,SO42-,NO3- | D. | Fe3+,SCN-,Na+,CO32- |
12.下列叙述不正确的是( )
| A. | c(NH4+)相等的NH4HCO3溶液、(NH4)2Fe(SO4)2溶液和(NH4)2SO4溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4HCO3) | |
| B. | 常温下,0.1 mol•L-1HCl溶液与等体积0.1 mol•L-1Ba(OH)2溶液混合后,溶液的pH=13 | |
| C. | 常温下,由水电离产生的c(H+)=10-13 mol•L-1的溶液,Fe2+、NO3-、Cl-、SO42-一定不能大量共存 | |
| D. | 0.1 mol•L-1的NaHCO3溶液中,c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |
13.某无色透明溶液,能与铝作用放氢气,则此溶液中一定可以大量共存的离子组是( )
| A. | K+、Na+、Cl- | B. | K+、Cu2+、SO42- | C. | Cl-、NO3-、Mg2+ | D. | Ba2+、SO42-、Na+ |


 .
.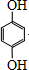 .
.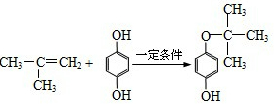 ,反应类型是加成反应.
,反应类型是加成反应.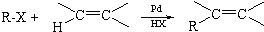


 ;F→G:
;F→G: .
. .
.