题目内容
12.离子反应方程式H++OH-=H2O,可表示的化学反应是( )| A. | Cu(OH)2和稀H2SO4反应 | B. | HNO3和Mg(OH)2反应 | ||
| C. | Ba(OH)2溶液和HCl溶液混合 | D. | NaOH和CH3COOH反应 |
分析 离子反应方程式“H++OH-=H2O“可表示的化学反应为可溶性强酸和可溶性强碱之间的反应,且生成的盐为可溶性强电解质,据此分析解答.
解答 解:离子反应方程式“H++OH-=H2O“可表示的化学反应为可溶性强酸和可溶性强碱之间的反应,且生成的盐为可溶性强电解质,
A.Cu(OH)2是难溶性弱电解质,不符合条件,离子方程式为2H++Cu(OH)2=2H2O+Cu2+,故A错误;
B.Mg(OH)2是难溶性弱电解质,不符合条件,2H++Mg(OH)2=2H2O+Mg2+,故B错误;
C.Ba(OH)2、HCl都是可溶性强电解质,且生成的盐为可溶性强电解质,符合条件,离子方程式为H++OH-=H2O,故C正确;
D.CH3COOH是弱电解质,不符合条件,离子方程式为CH3COOH+OH-=H2O+CH3COO-,故D错误;
故选C.
点评 本题考查离子方程式的书写,为高频考点,侧重考查学生分析判断及知识灵活运用能力,明确电解质强弱、电解质溶解性强弱及离子方程式书写特点是解本题关键,题目难度不大.

练习册系列答案
相关题目
8.现有常温下pH=2的醋酸溶液,下列有关叙述正确的是( )
| A. | c(H+)=c(CH3COO-) | |
| B. | 醋酸的物质的量浓度为0.01mol•L-1 | |
| C. | 与pH=12的NaOH溶液等体积混合后,溶液呈碱性 | |
| D. | 加入醋酸钠固体可抑制醋酸的电离,但电离常数Ka不变 |
3.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
20.下列有机化学反应方程式书写及反应类型均正确的是( )
| A. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl 加聚反应 | |
| B. | CH3COOH+CH3CH2OH $?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O 酯化反应 | |
| C. | 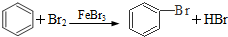 加成反应 加成反应 | |
| D. | 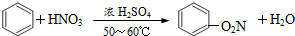 取代反应 取代反应 |
17.“绿色化学”对化学反应提出了“原子经济性”(原子节约)的新概念及要求,理想原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放.下列反应类型一定符合这一要求的是( )
①取代反应 ②加成反应 ③消去反应 ④水解反应 ⑤酯化反应 ⑥加聚反应.
①取代反应 ②加成反应 ③消去反应 ④水解反应 ⑤酯化反应 ⑥加聚反应.
| A. | ②④ | B. | ①④ | C. | ③⑤ | D. | ②⑥ |
4.下列有关金属腐蚀与防护的说法正确的是( )
| A. | 纯银器表面在空气中因化学腐蚀渐渐变暗 | |
| B. | 当镀铜铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| C. | 铁制品长期与氯化铵溶液接触,易发生吸氧腐蚀 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
1.下列对聚丙烯酸酯不正确的说法是( )
| A. | 单体的结构简式为CH2═CHCOOR | B. | 在一定条件下能发生加成反应 | ||
| C. | 在一定条件下能发生水解反应 | D. | 没有固定熔沸点 |
2.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 含有NA个氮原子的氮气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105Pa,64g SO2中含有的原子数小于3NA | |
| C. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| D. | 标准状况下,11.2L H2O含有的分子数为0.5NA |