题目内容
1.下列对聚丙烯酸酯不正确的说法是( )| A. | 单体的结构简式为CH2═CHCOOR | B. | 在一定条件下能发生加成反应 | ||
| C. | 在一定条件下能发生水解反应 | D. | 没有固定熔沸点 |
分析 聚丙烯酸酯的结构简式为 ,该物质中含有酯基,具有酯的性质,为高分子化合物,据此分析解答.
,该物质中含有酯基,具有酯的性质,为高分子化合物,据此分析解答.
解答 解:A.聚丙烯酸酯的结构简式为 ,根据其结构简式知,其单体为CH2═CHCOOR,故A正确;
,根据其结构简式知,其单体为CH2═CHCOOR,故A正确;
B.该分子中不含碳碳不饱和键、醛基、羰基或苯环,所以不能发生加成反应,故B错误;
C.该物质中含有酯基,所以在一定条件下能发生水解反应,故C正确;
D.该物质中n不同导致其成分不同,该物质是混合物,没有固定熔沸点,故D正确;
故选B.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确聚丙烯酸酯结构特点是解本题关键,注意:该化学式中不含碳碳双键,为易错点.

练习册系列答案
相关题目
11.25℃时,若pH=a的10体积某强酸溶液与pH=b的1体积某强碱溶液混合后溶液呈中性,则混合之前该强酸的pH与强碱的pH之间应满足的关系( )
| A. | a+b=14 | B. | a+b=13 | C. | a+b=15 | D. | a+b=7 |
12.离子反应方程式H++OH-=H2O,可表示的化学反应是( )
| A. | Cu(OH)2和稀H2SO4反应 | B. | HNO3和Mg(OH)2反应 | ||
| C. | Ba(OH)2溶液和HCl溶液混合 | D. | NaOH和CH3COOH反应 |
9.对可逆反应N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1下列叙述正确的是( )
| A. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| B. | 若单位时间内生成x mol N2的同时,消耗2x molNH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,2v (H2) 正=3v (NH3) 逆 | |
| D. | 加入催化剂,正反应速率增大,逆反应速率不变 |
16.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 18g H2O在标准状况下的体积是22.4L | |
| C. | 2.3g金属钠变为钠离子时失去的电子数为NA | |
| D. | 通常状况下,NA个CO2分子占有的体积为22.4L |
6.在一定条件下活性铁粉与氨气反应合成半导体材料:8Fe(s)+2NH3(g) $\frac{\underline{\;640℃\;}}{\;}$2Fe4N(s)+3H2(g)
下列有关NH3、H2的推断正确的是( )
下列有关NH3、H2的推断正确的是( )
| A. | 上述参加反应的NH3和生成H2的体积之比为3:2 | |
| B. | 同温同压下,NH3、H2的密度之比为2:17 | |
| C. | 相同质量的NH3、H2分子数之比为17:2 | |
| D. | 同温同体积下,相同质量NH3、H2的压强之比为2:17 |
13.高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为:2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+5H2O,下列说法正确的是( )
| A. | ClO-做还原剂 | B. | Fe(OH)3在反应中被还原 | ||
| C. | 高铁酸钾中铁的化合价为+7 | D. | 制备1molK2FeO4时转移3 mol 电子 |
10.已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1,下列说法正确的是( )
| A. | CO的燃烧热为-283 kJ•mol-1 | |
| B. | CO的燃烧热为566 kJ•mol-1 | |
| C. | CO的燃烧热△H=-283 kJ•mol-1 | |
| D. | 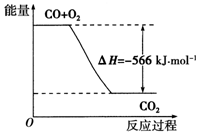 如图可表示由CO生成CO2的反应过程和能量关系 |
 ,其中氮的化合价为-2;
,其中氮的化合价为-2;