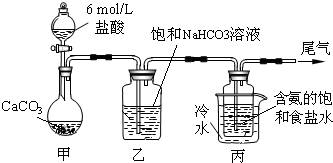
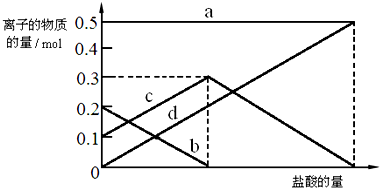
题目内容
20.下列溶液中Cl-浓度与50mL1mol•L-1AlCl3溶液中Cl-浓度相等的是( )| A. | 150mL1mol•L-1的NaCl溶液 | B. | 75mL4mol•L-1的NH4Cl溶液 | ||
| C. | 75mL1mol•L-1的FeCl3溶液 | D. | 150mL2mol•L-1的KCl溶液 |
分析 50mL1mol/L的AlCl3溶液中的Cl-浓度为3mol/L,根据溶质化学式计算各选项中的Cl-物质的量,进行比较可知.注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.
解答 解:50mL1mol/L的AlCl3溶液中的Cl-浓度为3mol/L.
A、150ml1mol/L的NaCl溶液中Cl-浓度为1mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度不相等,故A不符合;
B、75mL4mol•L-1的NH4Cl溶液中Cl-浓度为4mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度不相等,故B不符合;
C、75mL1mol•L-1的FeCl3溶液溶液中Cl-浓度为3mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度相等,故C符合;
D、150m2mol/L的KCl溶液中Cl-浓度为2mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度不相等,故D不符合.
故选C.
点评 本题考查物质的量浓度的计算与理解,题目难度不大,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案
相关题目
11.A、B、C、D、E是五种短周期元素.已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等.甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子.
请回答下列问题:
(1)C的最低价氢化物与乙相比较,稳定性强弱关系(用相应的化学式表示):H2O>CH4
(2)元素E在周期表中的位置为第三周期VIIA族
(3)请写出两种与乙具有相同电子数的非单核离子的化学式:NH4+和OH-
(4)把D的单质放到NaOH溶液中,反应的化学方程式为:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
(5)写出甲的电子式: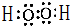
(6)有200mL MgCl2和丙的混合溶液,其中c(Mg2+)=0.2mol•L-1,c(Cl-)=1.3mol•L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4mol•L-1 NaOH 溶液的体积是:80mL.
| 物质组成 | 甲 | 乙 | 丙 | 丁 |
| 各元素原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
(1)C的最低价氢化物与乙相比较,稳定性强弱关系(用相应的化学式表示):H2O>CH4
(2)元素E在周期表中的位置为第三周期VIIA族
(3)请写出两种与乙具有相同电子数的非单核离子的化学式:NH4+和OH-
(4)把D的单质放到NaOH溶液中,反应的化学方程式为:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
(5)写出甲的电子式:
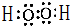
(6)有200mL MgCl2和丙的混合溶液,其中c(Mg2+)=0.2mol•L-1,c(Cl-)=1.3mol•L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4mol•L-1 NaOH 溶液的体积是:80mL.
8.将如图所示实验装置的K闭合,下列判断正确的是( )
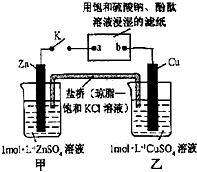

| A. | Cu电极上发生还原反应 | B. | 电子沿Zn→a→b→Cu路径流动 | ||
| C. | 片刻后甲池中c(SO42-)增大 | D. | 片刻后可观察到滤纸b点变红色 |
15.将固体NH4I置于密闭容器中,在某温度下发生下列反应:NH4I(s)?NH3(g)+HI(g);2HI(g)?H2(g)+I2(g),当反应达到平衡时,C(H2)=0.5mol/L,C(HI)=4mol/L,则第一个反应在该温度下的平衡常数是( )
| A. | 20 | B. | 15 | C. | 25 | D. | 16 |
5.在含有硫离子,且能使酚酞变红的无色溶液中,能大量共存的离子组是( )
| A. | Na+、Cu2+、Br-、Ba2+ | B. | Na+、SO32-、SO42-、K+ | ||
| C. | K+、MnO4-、NO3-、Na+ | D. | K+、Ca2+、SO32-、Cl- |
12.常温下把铁片投入下列溶液中,铁片被溶解,溶液的质量增加但没有气体产生的是( )
| A. | 硫酸铁溶液 | B. | 浓硝酸 | C. | 盐酸 | D. | 硫酸铜溶液 |
14.下面用序号给出了周期表中的部分元素,请从 ①~⑧中选择合适的元素回答下列问题:
(1)上述元素中原子半径最大的是(填元素符号)Na,气态氢化物最稳定的是(填化学式,下同)HF,气态氢化物水溶液呈碱性的是NH3,最高价氧化物对应水化物酸性最强的是NaOH.
(2)元素①与③按原子个数1:2构成的分子的电子式为 .
.
(3)元素⑤和⑦的最高价氧化物对应水化物反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O.
周期 主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ① | ② | ③ | ④ | |||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)元素①与③按原子个数1:2构成的分子的电子式为
 .
.(3)元素⑤和⑦的最高价氧化物对应水化物反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O.
 .
.