题目内容
12.常温下把铁片投入下列溶液中,铁片被溶解,溶液的质量增加但没有气体产生的是( )| A. | 硫酸铁溶液 | B. | 浓硝酸 | C. | 盐酸 | D. | 硫酸铜溶液 |
分析 铁片溶解,溶液质量增加,但无气体产生,则Fe与选项中物质发生化学反应,不生成质量大的金属或只溶解不析出,以此来解答.
解答 解:A.反应生成硫酸亚铁,无固体析出,溶液质量增加,且没有气体生成,故A正确;
B.发生钝化反应,铁不溶解,故B错误;
C.反应生成氢气,故C错误;
D.Fe置换出Cu,溶液质量减小,故D错误.
故选A.
点评 本题考查铁的化学性质,为高频考点,把握发生的氧化还原反应为解答的关键,注意质量变化及是否生成气体即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列化学用语正确的是( )
| A. | 中子数为8的碳原子:814C | B. | 氟离子的结构示意图: | ||
| C. | 二氧化碳的结构式:O=C=O | D. | N2的电子式: |
3.某烃有两种或两种以上的同分异构体,其同分异构体中的某一种烃的一氯代物只有一种,则这种烃可能是
( )
①分子中具有7个碳原子的芳香烃 ②分子中具有4个碳原子的烷烃
③分子中具有5个碳原子的烷烃 ④分子中具有8个碳原子的烷烃.
( )
①分子中具有7个碳原子的芳香烃 ②分子中具有4个碳原子的烷烃
③分子中具有5个碳原子的烷烃 ④分子中具有8个碳原子的烷烃.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
20.下列溶液中Cl-浓度与50mL1mol•L-1AlCl3溶液中Cl-浓度相等的是( )
| A. | 150mL1mol•L-1的NaCl溶液 | B. | 75mL4mol•L-1的NH4Cl溶液 | ||
| C. | 75mL1mol•L-1的FeCl3溶液 | D. | 150mL2mol•L-1的KCl溶液 |
7.下列叙述不正确的是( )
| A. | 0.1 mol/L的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | 0.1 mol/L的Na2CO3溶液中:c(Na+ )+2[c(CO3 2-)+c(HCO3-)+c(H2CO3)] | |
| C. | 浓度均为0.1mol•L-1 的碳酸钠溶液和氨水溶液中,由水电离的出的 c(OH-):前者大于后者 | |
| D. | 浓度为0.1 mol/L NH4Cl和0.1mol/L NH3•H2O等体积混合溶液中pH>7,则:c(NH4+ )>c(Cl-)>c(OH-)>c(NH3•H2O)>c(H+) |
2.常温下体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( 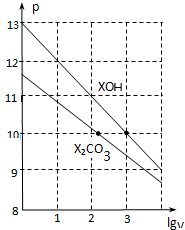

| A. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| B. | 已知常温下,0.1 mol•L-1 XHCO3溶液的pH=8.31,则Ka1(H2CO3)•Ka2(H2CO3)>Kw | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 |
9.下表列出了A~M 13种元素在周期表中的位置:
(1)这些元素中,金属性最强的元素是钾(填元素名称),非金属性最强的元素是氟(填元素名称),最不活泼的元素是Ar(填元素符号),原子半径最小的元素是H(填元素符号).
(2)写出C元素的气态氢化物与I元素的最高价氧化物的水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
(3)将C、D、E三种元素的氢化物按还原性增强的顺序排列为HF<H2O<NH3.(用化学式表示)
(4)I2-、J-、L+、M2+等微粒中,半径最大的是S2-(填离子符号).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅤⅠA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
(2)写出C元素的气态氢化物与I元素的最高价氧化物的水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
(3)将C、D、E三种元素的氢化物按还原性增强的顺序排列为HF<H2O<NH3.(用化学式表示)
(4)I2-、J-、L+、M2+等微粒中,半径最大的是S2-(填离子符号).