题目内容
15.有一固体粉末可能含有下列离子中的几种:K+、Mg2+、Fe3+、Ba2+、NO3-、CO32-、Cl-、SO42-.某小组同学为了确定其组成进行了如下实验:| 实验步骤 | 实验现象 |
| ①取少量固体于试管中,加入足量蒸馏水 | 得到无色溶液和白色不溶物 |
| ②向上述试管中加入足量稀盐酸 | 有气泡冒出,白色不溶物部分溶解 |
| ③将步骤②所得物过滤,取部分滤液于试管中,向其中加入少量硝酸银溶液 | 有白色沉淀生成 |
| ④另取步骤③所得滤液少许于试管中,向其中加入足量氢氧化钠溶液 | 无明显现象 |
(1)原固体粉末中一定不含Mg2+、Fe3+(填离子符号,下同),肯定含有Ba2+、SO42-、CO32-,不能确定是否含有的阴离子是NO3-、Cl-.
(2)步骤②中白色不溶物部分溶解时发生反应的离子方程式为BaCO3+2H+=Ba2++H2O+CO2↑.
(3)若取步骤①中得到的无色溶液少许于试管中,先向其中加入过量的稀硝酸,再加入过量的硝酸钡溶液,过滤后向滤液中加入硝酸银溶液,产生白色沉淀,证明原固体粉末中一定含有Cl-(填离子符号,下同),加入过量稀硝酸的目的是排除CO32-的干扰,加入过量硝酸钡溶液的目的是排除SO42-的干扰.
分析 Mg2+、Fe3+、Ba2+均与CO32-反应生成沉淀,Ba2+、SO42-反应生成沉淀,由实验①②可知,沉淀为BaSO4、不溶性碳酸盐,则原溶液中一定含Ba2+、SO42-、CO32-,③中白色沉淀为AgCl,但②中加盐酸引入氯离子,由实验④无现象可知,原溶液中不含Mg2+、Fe3+,以此来解答.
解答 解:(1)由上述分析可知,原固体粉末中一定不含Mg2+、Fe3+,一定含Ba2+、SO42-、CO32-,不能确定是否含有的阴离子是NO3-、Cl-,
故答案为:Mg2+、Fe3+;Ba2+、SO42-、CO32-;NO3-、Cl-;
(2)步骤②中白色不溶物部分溶解时发生反应的离子方程式为BaCO3+2H+=Ba2++H2O+CO2↑,故答案为:BaCO3+2H+=Ba2++H2O+CO2↑;
(3)若取步骤①中得到的无色溶液少许于试管中,先向其中加入过量的稀硝酸,再加入过量的硝酸钡溶液,过滤后向滤液中加入硝酸银溶液,产生白色沉淀,白色沉淀为AgCl,证明原固体粉末中一定含有Cl-,碳酸银、硫酸银为沉淀,则加入过量稀硝酸的目的是排除CO32-的干扰,加入过量硝酸钡溶液的目的是排除SO42-的干扰,
故答案为:Cl-;CO32-;SO42-.
点评 本题考查离子及物质的推断,为高频考点,把握实验流程中发生的反应、离子共存、元素化合物知识为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
相关题目
15.下列可用于鉴别以下两种化合物的试剂是( )
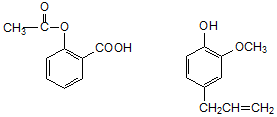

| A. | 银氨溶液 | B. | 稀溴水 | C. | 氯化铁溶液 | D. | 氢氧化钠溶液 |
16.下列事实不能用元素周期律解释的是( )
| A. | 酸性:HClO4>H2SO4 | |
| B. | Na、Mg与水反应,Na更剧烈 | |
| C. | 气态氢化物的稳定性:HF>HCl | |
| D. | 向Na2SO3溶液中加盐酸,有气泡产生 |
10.五种固体物质 A、B、C、D、E 由下表中不同的阴阳离子组成,它们均易溶于水.
分别取它们的水溶液进行实验,结果如下:
①A 溶液与 C 溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀 HNO3,沉淀部分溶解,剩余 白色固体;
②B 溶液与 E 溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量 C 溶液与 D 溶液混合后产生白色沉淀,过量 C 溶液与 D 溶液混合后无现象;
④B 溶液与 D 溶液混合后无现象;
⑤将 38.4g Cu 片投入装有足量 D 溶液的试管中,Cu 片不溶解,再滴加 1.6mol/L 稀 H2SO4,Cu 逐渐溶解,管口附近有红棕色气体出现.
(1)据此推断 A 的化学式为:ACuSO4;BFeCl3
(2)写出过量 C 与 D 发生反应的离子方程式Al3++4OH-=AlO2-+2H2O.
(3)B 溶液中滴入石蕊试液,现象是溶液变红,原因是Fe3++3H2O?Fe(OH)3+3H+(用离子方程式说明)
分别取它们的水溶液进行实验,结果如下:
| 阳离子 | Na+ | Al3+ | Fe3+ | Cu2+ | Ba2+ |
| 阴离子 | OH- | Cl- | CO32- | NO3- | SO42- |
②B 溶液与 E 溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量 C 溶液与 D 溶液混合后产生白色沉淀,过量 C 溶液与 D 溶液混合后无现象;
④B 溶液与 D 溶液混合后无现象;
⑤将 38.4g Cu 片投入装有足量 D 溶液的试管中,Cu 片不溶解,再滴加 1.6mol/L 稀 H2SO4,Cu 逐渐溶解,管口附近有红棕色气体出现.
(1)据此推断 A 的化学式为:ACuSO4;BFeCl3
(2)写出过量 C 与 D 发生反应的离子方程式Al3++4OH-=AlO2-+2H2O.
(3)B 溶液中滴入石蕊试液,现象是溶液变红,原因是Fe3++3H2O?Fe(OH)3+3H+(用离子方程式说明)
7.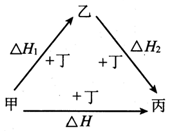 甲、乙、丙、丁四种物质在一 定条件下的转化关系如图所示,当乙作为反应物且与甲的物质的量相等时,△H=△H1+△H2.则甲、丙可能是( )
甲、乙、丙、丁四种物质在一 定条件下的转化关系如图所示,当乙作为反应物且与甲的物质的量相等时,△H=△H1+△H2.则甲、丙可能是( )
 甲、乙、丙、丁四种物质在一 定条件下的转化关系如图所示,当乙作为反应物且与甲的物质的量相等时,△H=△H1+△H2.则甲、丙可能是( )
甲、乙、丙、丁四种物质在一 定条件下的转化关系如图所示,当乙作为反应物且与甲的物质的量相等时,△H=△H1+△H2.则甲、丙可能是( )| A. | S、SO3 | B. | AlCl3、NaAlO2 | C. | Na、Na2O2 | D. | NaOH、Na2CO3 |
 草木灰主要含有K2CO3,还含有K2SO4和KCl.某化学兴趣小组拟从草木灰中提取出钾盐晶体,并测定K2CO3的含量.
草木灰主要含有K2CO3,还含有K2SO4和KCl.某化学兴趣小组拟从草木灰中提取出钾盐晶体,并测定K2CO3的含量.