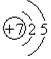题目内容
17.已知下列三种气态物质之间的反应:C2H2(g)+H2(g)?C2H4(g) ①
2CH4(g)?C2H4(g)+2H2(g) ②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:
C(s)+2H2(g)=CH4(g);△H=-Q1 kJ/mol
C(s)+$\frac{1}{2}$H2(g)=$\frac{1}{2}$C2H2(g);△H=-Q2 kJ/mol
C(s)+H2(g)=$\frac{1}{2}$C2H4(g);△H=-Q3 kJ/mol
Q1、Q2、Q3均为正值,下列关系正确的是( )
| A. | Q1>Q3>Q2 | B. | Q1>Q2>Q3 | C. | Q2>Q1>Q3 | D. | Q3>Q1>Q2 |
分析 先根据温度变化所引起平衡移动的方向判断反应①、反应②的热效应,然后利用盖斯定律判断即可.
解答 解:当温度降低时,反应①的平衡向正反应方向移动,说明该反应正向为放热反应,△H<0,反应②的平衡向逆反应方向移动,说明该反应正向为吸热反应,△H>0,
已知下列两个气态物质之间的反应:C2H2(g)+H2(g)?C2H4(g)…①,
2CH4(g)?C2H4(g)+2H2(g)…②,
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:
(1)C(s)+2H2(g)?CH4(g),△H=-Q1…Ⅰ
(2)C(s)+$\frac{1}{2}$H2(g)?$\frac{1}{2}$C2H2(g),△H=-Q2…Ⅱ
(3)C(s)+H2(g)?$\frac{1}{2}$C2H4(g),△H=-Q3…Ⅲ,
利用盖斯定律,2×[(3)-(2)],得到C2H2(g)+H2(g)?C2H4(g),△H=2(Q2-Q3),
与题干中的①中的方程式一样,而①中的反应为放热反应,则Q2-Q3<0,所以Q2<Q3;
同理:2×[(3)-(1)],得到2CH4(g)?C2H4(g)+2H2(g),△H=2(Q1-Q3),与题干中的②中的方程式一样,而②中的反应为吸热反应,则2(Q1-Q3)>0,所以Q1>Q3;
综上所述Q1>Q3>Q2.
故选:A.
点评 本题考查了反应热的计算、热化学方程式和盖斯定律计算应用,为高频考点,侧重考查学生的分析、计算能力的考查,注意把握反应热的计算方法、热化学方程式的书写方法以及盖斯定律的含义,题目难度中等

练习册系列答案
相关题目
19.(1)已知25℃时有关弱酸的电离平衡常数:
①同温度下,等pH值的NaHCO3、NaCN、Na2CO3溶液的物质的量浓度由大到小的顺序为NaHCO3>NaCN>Na2CO3.
②若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号)
a.c(CH3COO-) b.c(H+) c.KW d.醋酸电离平衡常数.
(2)上述提供的同浓度酸中,酸性最强的是HSCN;酸性最弱的是HCO3-;若向NaCN溶液中通入少量的CO2,发生反应的离子方程式CN-+H2O+CO2=HCN+HCO3-.
(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3.Na2CO3俗称纯碱,该溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+);同浓度的碳酸钠溶液和碳酸氢钠溶液pH较大的是Na2CO3.
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
②若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号)
a.c(CH3COO-) b.c(H+) c.KW d.醋酸电离平衡常数.
(2)上述提供的同浓度酸中,酸性最强的是HSCN;酸性最弱的是HCO3-;若向NaCN溶液中通入少量的CO2,发生反应的离子方程式CN-+H2O+CO2=HCN+HCO3-.
(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3.Na2CO3俗称纯碱,该溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+);同浓度的碳酸钠溶液和碳酸氢钠溶液pH较大的是Na2CO3.
5.Na2SO3的氧化反应:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq)△H=m kJ•mol-1.其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段.
(1)已知O2(g)?O2(aq)△H=nkJ•mol-1,Na2SO3溶液与O2(g)反应的热化学方程式为2Na2SO3(aq)+O2(g)=2Na2SO4(aq)△H=(m+n)kJ•mol-1
(2)291.5K时,1.0L溶液中Na2SO3初始量分别为4、6、8、12mmol,溶解氧浓度初始值为9.60mg•L-1,每5s记录溶解氧浓度,实验结果如图.当Na2SO3的初始量为12mmol,经过20s溶解氧浓度降为6.40mg•L-1,则0-20s内Na2SO3的平均反应速率为1.00×10-5mol•L-1•s-1
(3)为确定贫氧区速率方程v=kca(SO32-)•cb(O2)中a,b的值(取整数),分析实验数据.
①当溶解氧浓度为4.0mg•L-1时,c(Na2SO3)与速率数值关系如表,则a=2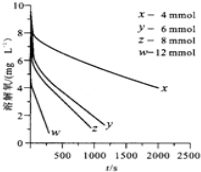
②当溶解氧浓度小于4.0mg•L-1时,图中曲线皆为直线,则b=0,
(4)两个阶段不同温度的速率常数(k)之比如表.
已知ln$\frac{{k}_{2}}{{k}_{1}}$=-$\frac{{E}_{a}}{R}$($\frac{1}{{T}_{2}}-\frac{1}{{T}_{1}}$),R为常数,Ea(富氧区)<Ea(贫氧区)(填“>”或“<”).
(5)结合图表分析,Na2SO3初始量不同时,划分富氧区与贫氧区的溶解氧浓度是否相同,为什么?.
(6)一定温度下,化学反应速率仅与决速步的反应物浓度有关.Na2SO3氧化反应历程涉及的
①SO32-+O2→SO5-
②SO5-+SO32-→SO52-+SO3-
③SO32-+SO32-→SO3-+SO32-
④SO32-+O2→SO5-
⑤SO52-+SO32-→2SO42-
富氧区与和贫氧区的决速步分别是①、③(填序号)
(1)已知O2(g)?O2(aq)△H=nkJ•mol-1,Na2SO3溶液与O2(g)反应的热化学方程式为2Na2SO3(aq)+O2(g)=2Na2SO4(aq)△H=(m+n)kJ•mol-1
(2)291.5K时,1.0L溶液中Na2SO3初始量分别为4、6、8、12mmol,溶解氧浓度初始值为9.60mg•L-1,每5s记录溶解氧浓度,实验结果如图.当Na2SO3的初始量为12mmol,经过20s溶解氧浓度降为6.40mg•L-1,则0-20s内Na2SO3的平均反应速率为1.00×10-5mol•L-1•s-1
(3)为确定贫氧区速率方程v=kca(SO32-)•cb(O2)中a,b的值(取整数),分析实验数据.
| c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
| v×106 | 10.2 | 24.4 | 44.7 | 103.6 |

②当溶解氧浓度小于4.0mg•L-1时,图中曲线皆为直线,则b=0,
(4)两个阶段不同温度的速率常数(k)之比如表.
| 反应阶段 | 速率方程 | $\frac{k(297.0K)}{k(291.5K)}$ |
| 富氧区 | v=kc(SO32-)•c(O2) | 1.47 |
| 贫氧区 | v=kca(SO32-)•cb(O2) | 2.59 |
(5)结合图表分析,Na2SO3初始量不同时,划分富氧区与贫氧区的溶解氧浓度是否相同,为什么?.
(6)一定温度下,化学反应速率仅与决速步的反应物浓度有关.Na2SO3氧化反应历程涉及的
①SO32-+O2→SO5-
②SO5-+SO32-→SO52-+SO3-
③SO32-+SO32-→SO3-+SO32-
④SO32-+O2→SO5-
⑤SO52-+SO32-→2SO42-
富氧区与和贫氧区的决速步分别是①、③(填序号)
9.室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( )

| A. | 三种酸的电离常数关系:KHA>KHB>KHD | |
| B. | 滴定至P点时,溶液中:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-) | |
| C. | pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) | |
| D. | 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-) |
6.实验室从含氯化钠、硝酸钾混合液中提取KNO3的过程如图所示.下列分析正确的是( )


| 选项 | 操作1 | 操作2 | 操作3 | 操作4 |
| A | 溶解 | 结晶 | 蒸发 | 过滤 |
| B | 蒸发 | 过滤 | 冷却 | 过滤 |
| C | 蒸发 | 结晶 | 结晶 | 蒸发 |
| D | 过滤 | 结晶 | 冷却 | 结晶 |
| A. | A | B. | B | C. | C | D. | D |
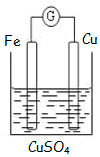 如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.
如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓. 一定温度下,在2L的密闭容器中充入0.4mol SO2和0.2mol O2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,n(O2)随时间的变化关系如图实线所示:
一定温度下,在2L的密闭容器中充入0.4mol SO2和0.2mol O2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,n(O2)随时间的变化关系如图实线所示: