题目内容
下列说法正确的是( )
| A、CaCl2、NaOH、HCl、HD四种物质都属于化合物 |
| B、蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| C、可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 |
| D、晶体中一定存在化学键 |
考点:单质和化合物,化学键,强电解质和弱电解质的概念,物质的检验和鉴别的基本方法选择及应用
专题:
分析:A.HD是单质;
B.强电解质是指在水中完全电离成离子的化合物;弱电解质是指在水中不完全电离,只有部分电离的化合物;在水溶液里或熔融状态下都不导电的化合物是非电解质,在水溶液中或熔化状态下能导电的化合物为电解质;
C.澄清石灰水与Na2CO3溶液和NaHCO3溶液反应都生成白色沉淀;
D.单原子分子晶体,不存在化学键.
B.强电解质是指在水中完全电离成离子的化合物;弱电解质是指在水中不完全电离,只有部分电离的化合物;在水溶液里或熔融状态下都不导电的化合物是非电解质,在水溶液中或熔化状态下能导电的化合物为电解质;
C.澄清石灰水与Na2CO3溶液和NaHCO3溶液反应都生成白色沉淀;
D.单原子分子晶体,不存在化学键.
解答:
解:A.HD是氢元素的同位素原子形成的单质,故A错误;
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质,故B正确;
C.澄清石灰水与Na2CO3溶液和NaHCO3溶液反应都生成白色沉淀,无法鉴别,故C错误;
D.氩气为稀有气体,是单原子分子,不存在化学键,故D错误.
故选B.
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质,故B正确;
C.澄清石灰水与Na2CO3溶液和NaHCO3溶液反应都生成白色沉淀,无法鉴别,故C错误;
D.氩气为稀有气体,是单原子分子,不存在化学键,故D错误.
故选B.
点评:本题考查常见的概念、物质的鉴别和化学键,了解常见物质的组成、抓住各概念的特征进行分析判断是解答此类题的关键,采用排除法是正确、快速解答此类题的捷径.

练习册系列答案
相关题目
用下列实验装置进行相应实验,能达到实验目的是( )


| A、实验室用图1所示装置制取少量氨气 |
| B、用图2 所示装置蒸干AlCl3饱和溶液制备无水AlCl3 |
| C、用图3装置测量Cu与浓硝酸反应产生气体的体积 |
| D、用图4所示装置可除去CO2中含有的少量HCl |
下列各项的叙述中都包含两个数值,前一数值大于后一数值的是( )
| A、硅烷分子中Si-H键的极性和HF中H-F的极性 |
| B、乙烯CH2=CH2中碳碳σ键的键能和碳碳π键的键能 |
| C、1molCO2晶体C=O键数目和1molSiO2晶体Si-O键数目 |
| D、N2中的分子间作用力和CO中的分子间作用力 |
在金属钠与水反应的实验中不能反映出钠的性质是( )
| A、良导体 | B、还原性强 |
| C、密度小 | D、熔点低 |
在乙烯分子中有σ键和π键,下列说法不正确的是( )
| A、中心原子采用sp2杂化 |
| B、乙烯分子中有4个σ键和2个π键 |
| C、杂化轨道形成σ键、未杂化的2p轨道形成π键 |
| D、乙烯分子中所有原子一定在同一平面 |
下列实验中,所选装置不合理的是( )


| A、粗盐提纯,选①和② |
| B、用CCl4提取碘水中的碘,选③ |
| C、分离Na2CO3溶液和CH3COOC2H5,选④ |
| D、用NaOH溶液吸收Cl2,选⑤ |
下列反应属于离子反应的是( )
| A、NH3遇HCl气体生成白烟 |
| B、H2和O2反应生成水 |
| C、锌片投入稀硫酸中 |
| D、KMnO4加热分解制取O2 |
有下列一整套电化学装置,关于该装置说法正确的是( )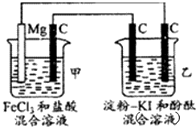

| A、甲池中Mg极为阳极,电极反应式为:Mg-2r-═Mg2+ |
| B、甲池中:当Mg减少2.4g时,石墨(C)极上产生2.24L气体 |
| C、乙池中将化学能转化为电能 |
| D、乙池左侧石墨电极附近变蓝,右侧石墨电极附近变红 |
在下列各项中,化学反应前后肯定没有发生改变的是( )
①原子的数目
②分子的数目
③元素的种类
④物质的总质量
⑤物质的种类
⑥原子的种类.
①原子的数目
②分子的数目
③元素的种类
④物质的总质量
⑤物质的种类
⑥原子的种类.
| A、①③④⑤ | B、①③④⑥ |
| C、①④⑥ | D、①③⑤ |