题目内容
在乙烯分子中有σ键和π键,下列说法不正确的是( )
| A、中心原子采用sp2杂化 |
| B、乙烯分子中有4个σ键和2个π键 |
| C、杂化轨道形成σ键、未杂化的2p轨道形成π键 |
| D、乙烯分子中所有原子一定在同一平面 |
考点:共价键的形成及共价键的主要类型
专题:化学键与晶体结构
分析:乙烯的结构式为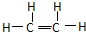 ,分子中含有一个双键和4个单键,单键中含有1个σ键,双键中含有1个σ键和1个π键,根据中心原子上σ键的数目判断杂化类型和分子的空间结构.
,分子中含有一个双键和4个单键,单键中含有1个σ键,双键中含有1个σ键和1个π键,根据中心原子上σ键的数目判断杂化类型和分子的空间结构.
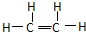 ,分子中含有一个双键和4个单键,单键中含有1个σ键,双键中含有1个σ键和1个π键,根据中心原子上σ键的数目判断杂化类型和分子的空间结构.
,分子中含有一个双键和4个单键,单键中含有1个σ键,双键中含有1个σ键和1个π键,根据中心原子上σ键的数目判断杂化类型和分子的空间结构.解答:
解:A、乙烯中C原子上含有3个σ键电子对,则中心原子采用sp2杂化,故A正确;
B、乙烯分子中含有一个双键和4个单键,则含有5个σ键和1个π键,故B错误;
C、在乙烯分子中杂化轨道形成σ键、未杂化的2p轨道形成π键,故C正确;
D、乙烯中中心原子采用sp2杂化,属于平面结构,所以乙烯分子中所有原子一定在同一平面,故D正确.
故选B.
B、乙烯分子中含有一个双键和4个单键,则含有5个σ键和1个π键,故B错误;
C、在乙烯分子中杂化轨道形成σ键、未杂化的2p轨道形成π键,故C正确;
D、乙烯中中心原子采用sp2杂化,属于平面结构,所以乙烯分子中所有原子一定在同一平面,故D正确.
故选B.
点评:本题考查了乙烯的结构、杂化类型的判断等,题目难度不大,注意把握乙烯的结构式.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
下列一定没有伴随化学变化的是( )
| A、电解质溶液导电 |
| B、活性炭使品红褪色 |
| C、钢铁缓慢氧化 |
| D、酚酞遇碱变红 |
体积相同的甲乙两容器中,一个充满HCl,另一个充满H2和Cl2的混合气体.同温、同压下,两个容器内的气体一定具有相同的( )
| A、原子总数 | B、分子总数 |
| C、质量 | D、密度 |
 2012年6月16日18时37分神舟九号飞船从酒泉卫星发射中心长征二号F型火箭发射升空,先后与天宫一号目标飞行器在轨成功进行了两次交会对接.长征二号F型火箭用的燃料是液体偏二甲基肼C2H8N2,氧化剂是液体N2O4,已知1.5g偏二甲基肼完
2012年6月16日18时37分神舟九号飞船从酒泉卫星发射中心长征二号F型火箭发射升空,先后与天宫一号目标飞行器在轨成功进行了两次交会对接.长征二号F型火箭用的燃料是液体偏二甲基肼C2H8N2,氧化剂是液体N2O4,已知1.5g偏二甲基肼完全燃烧生成氮气、二氧化碳和液态水放出热量50kJ.下列有关热化学方程式正确的是( )
| A、C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(l)△H=-50kJ?mol-1 |
| B、C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=-50kJ?mol-1 |
| C、C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(l)△H=-2000kJ?mol-1 |
| D、C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=-2000kJ?mol-1 |
下列实验方法能达到实验目的是( )
| A、向某无色溶液中先加入氯化钡溶液,生成白色沉淀,在加入足量盐酸,沉淀不溶解,说明原溶液中含有SO42- |
| B、用分液的方法分离溴和CCl4的混合物 |
| C、用水鉴别苯,四氯化碳,酒精三种液体 |
| D、用向上排空气法收集NO |
下列说法正确的是( )
| A、CaCl2、NaOH、HCl、HD四种物质都属于化合物 |
| B、蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| C、可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 |
| D、晶体中一定存在化学键 |
下列有关物质除杂的方法中可行的是( )
| A、除去石英中混有的少量铝粉,可加入氢氧化钠溶液溶解后过滤 |
| B、向含有少量FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取分液,以除去FeCl2溶液中的FeBr2 |
| C、除去乙酸乙酯中混有的少量乙酸,加入饱和氢氧化钠溶液振荡后分液 |
| D、已知:Ksp(CuS)<Ksp(FeS),可加入过量的难溶电解质FeS,使水中少量的Cu2+转化成硫化物沉淀而除去 |
下面的四个实验装置有三个都存在明显缺陷,其中完全正确的是( )
A、 溴丙烷消去并检验产物 |
B、 制取和收集氨气 |
C、 分离沸点不同的液体混合物 |
D、 制备乙烯 |
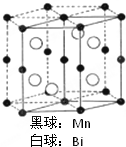 磁光盘机(Magnetic Optical Disk Drive,MO)是一种可重写的光盘驱动器,它使用磁光盘片作存储媒体.磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的.如图是该物质的晶体结构,其化学式可表示为( )
磁光盘机(Magnetic Optical Disk Drive,MO)是一种可重写的光盘驱动器,它使用磁光盘片作存储媒体.磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的.如图是该物质的晶体结构,其化学式可表示为( )