题目内容
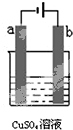 如图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )
如图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )| A、a电极的产物有Cu和H2 |
| B、反应一段时间后,溶液的pH值变小 |
| C、a电极附近呈红色,b电极附近出现蓝色 |
| D、a、b电极转移的电子数为0.8mol |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:n(CuSO4)=0.2mol/L×1L=0.2mol,b为阳极、a为阴极,阳极电极反应式为4OH--4e-=2H2O+O2↑,b电极生成气体物质的量=
=0.2mol,转移电子的物质的量=0.2mol×4=0.8mol,阴极上铜离子完全析出时转移电子的物质的量=0.2mol×2=0.4mol<0.8mol,所以阴极上含有氢离子放电生成氢气,据此分析解答.
| 4.48L |
| 22.4L/mol |
解答:
解:n(CuSO4)=0.2mol/L×1L=0.2mol,b为阳极、a为阴极,阳极电极反应式为4OH--4e-=2H2O+O2↑,b电极生成气体物质的量=
=0.2mol,转移电子的物质的量=0.2mol×4=0.8mol,阴极上铜离子完全析出时转移电子的物质的量=0.2mol×2=0.4mol<0.8mol,所以阴极上含有氢离子放电生成氢气,
A.通过以上分析知,a电极的产物有Cu和H2,故A正确;
B.开始时电池反应式为2CuSO4+2H2O
2Cu+O2↑+2H2SO4,当铜离子完全析出时电池反应式为2H2O
O2↑+2H2↑,反应一段时间后有硫酸生成,所以溶液的pH值变小,故B正确;
C.a电极附近有氢氧根离子生成,溶液呈碱性,所以酚酞试液呈红色,b电极有无色气体生成,故C错误;
D.通过以上分析知,a、b电极转移的电子数为0.8mol,故D正确;
故选C.
| 4.48L |
| 22.4L/mol |
A.通过以上分析知,a电极的产物有Cu和H2,故A正确;
B.开始时电池反应式为2CuSO4+2H2O
| ||
| ||
C.a电极附近有氢氧根离子生成,溶液呈碱性,所以酚酞试液呈红色,b电极有无色气体生成,故C错误;
D.通过以上分析知,a、b电极转移的电子数为0.8mol,故D正确;
故选C.
点评:本题考查电解原理,明确阴极上电极反应式是解本题关键,注意:要通过转移电子相等判断阴极产物,为易错点.

练习册系列答案
相关题目
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A、该试剂的物质的量浓度为9.2mol?L-1 |
| B、该硫酸50mL与足量的铜反应可得到标准状况下0.46mol气体 |
| C、配制200mL 4.6mol?L-1的稀硫酸需取该硫酸50mL |
| D、该硫酸与等体积的水混合所得溶液的质量分数小于49% |
 在25℃时,用0.125mol?L-1的标准盐酸滴定25.00mL未知浓度的NaOH溶液所得滴定曲线如图所示,图中K点代表的pH为( )
在25℃时,用0.125mol?L-1的标准盐酸滴定25.00mL未知浓度的NaOH溶液所得滴定曲线如图所示,图中K点代表的pH为( )| A、13 | B、12 | C、10 | D、11 |
关于如图所示装置的叙述,正确的是( )


| A、氢离子在铜片表面被还原 |
| B、铜片质量逐渐减少 |
| C、电流从锌片经导线流向铜片 |
| D、铜是阳极,铜片上有气泡产生 |
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )

| A、Mg 电极是该电池的正极 |
| B、溶液中的Cl-向正极移动 |
| C、H2O2 在石墨电极上发生氧化反应 |
| D、石墨电极附近溶液的pH 增大 |
在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8溶液会发生如下离子反应(未配平):Mn2++S2O82-+H2O→MnO4-+SO42-+H+,下列说法不正确的是( )
| A、氧化性比较:S2O82->MnO4- |
| B、氧化剂S2O82-的摩尔质量为192g/mol |
| C、该反应中酸性介质可以为盐酸 |
| D、若有0.1mol氧化产物生成,则转移电子0.5mol |