题目内容
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )

| A、Mg 电极是该电池的正极 |
| B、溶液中的Cl-向正极移动 |
| C、H2O2 在石墨电极上发生氧化反应 |
| D、石墨电极附近溶液的pH 增大 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该原电池中,Mg易失电子作负极,负极反应式为Mg-2e-=Mg2+,H2O2具有氧化性,所以石墨应为原电池的正极,被还原,电极反应式为H2O2+2H++2e-═2H2O,电解质溶液中阴离子向负极移动,据此分析解答.
解答:
解:A.该装置中,Mg易失电子发生氧化反应而作负极、石墨作正极,故A错误;
B.放电时,溶液中的氯离子向负极移动,故B错误;
C.双氧水在石墨电极上得电子发生还原反应,故C错误;
D.石墨电极反应式为H2O2+2H++2e-═2H2O,氢离子参加反应,导致溶液中pH增大,故D正确;
故选D.
B.放电时,溶液中的氯离子向负极移动,故B错误;
C.双氧水在石墨电极上得电子发生还原反应,故C错误;
D.石墨电极反应式为H2O2+2H++2e-═2H2O,氢离子参加反应,导致溶液中pH增大,故D正确;
故选D.
点评:本题考查原电池原理,明确正负极的判断方法、电极反应式的书写即可解答,难点是正极反应式的书写,要仔细揣摩.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、动态平衡状态在自然界和工农业生产中很少见 |
| B、化学反应的速率和限度均可通过改变相应的化学反应条件而改变 |
| C、物质发生化学反应都伴随着能量变化 |
| D、化学反应达到平衡状态时,正反应速率与逆反应速率相等 |
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A、反应前2min的平均速率v(Z)=2.0×10-3mol/(L?min) |
| B、其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正) |
| C、该温度下此反应的平衡常数K=144 |
| D、其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大 |
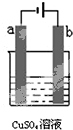 如图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )
如图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )| A、a电极的产物有Cu和H2 |
| B、反应一段时间后,溶液的pH值变小 |
| C、a电极附近呈红色,b电极附近出现蓝色 |
| D、a、b电极转移的电子数为0.8mol |
下列各化合物既能由金属与氯气直接反应制得,又能由金属与盐酸反应制得的是( )
| A、FeCl3 |
| B、CuCl2 |
| C、AlCl3 |
| D、FeCl2 |
X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
| A、原子序数X>Y |
| B、最外层电子数X>Y |
| C、原子半径X<Y |
| D、最高正价X<Y |