题目内容
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A、该试剂的物质的量浓度为9.2mol?L-1 |
| B、该硫酸50mL与足量的铜反应可得到标准状况下0.46mol气体 |
| C、配制200mL 4.6mol?L-1的稀硫酸需取该硫酸50mL |
| D、该硫酸与等体积的水混合所得溶液的质量分数小于49% |
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:A.根据c=
计算浓硫酸的物质的量浓度;
B.Cu与浓硫酸反应,与稀硫酸不反应,结合方程式计算判断;
C.根据稀释定律计算;
D.浓硫酸的密度大于水的密度,等体积混合后溶液质量小于浓硫酸的2倍,而混合后溶质硫酸的质量不变,据此判断.
| 1000ρw |
| M |
B.Cu与浓硫酸反应,与稀硫酸不反应,结合方程式计算判断;
C.根据稀释定律计算;
D.浓硫酸的密度大于水的密度,等体积混合后溶液质量小于浓硫酸的2倍,而混合后溶质硫酸的质量不变,据此判断.
解答:
解:由c=
可知,该浓硫酸的物质的量浓度为
mol/L=18.4mol/L,故A错误;
B.随反应的进行,浓硫酸变为稀硫酸,Cu与稀硫酸不反应,根据Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,可知生成二氧化硫小于0.05L×18.4mol/L×
=0.46mol,故B错误;
C.根据配制溶液前后硫酸的物质的量不变,需取该硫酸的体积为
=0.05L=50mL,故C正确;
D.浓硫酸的密度大于水的密度,等体积混合后溶液质量小于浓硫酸的2倍,而混合后溶质硫酸的质量不变,所以该硫酸与等体积的水混合所得溶液的质量分数大于49%,故D错误;
故选C.
| 1000ρw |
| M |
| 1000×1.84×98% |
| 98 |
B.随反应的进行,浓硫酸变为稀硫酸,Cu与稀硫酸不反应,根据Cu+2H2SO4(浓)
| ||
| 1 |
| 2 |
C.根据配制溶液前后硫酸的物质的量不变,需取该硫酸的体积为
| 0.2L×4.6mol/L |
| 18.4mol/L |
D.浓硫酸的密度大于水的密度,等体积混合后溶液质量小于浓硫酸的2倍,而混合后溶质硫酸的质量不变,所以该硫酸与等体积的水混合所得溶液的质量分数大于49%,故D错误;
故选C.
点评:本题考查溶液浓度有关计算,涉及物质的量浓度、质量分数计算,难度不大,注意理解掌握物质的量浓度与质量分数之间关系.

练习册系列答案
相关题目
在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g)?CH3OH(g) 正向为放热反应,第2min时只改变一个条件,反应情况如下表:下列说法不正确的是( )
| 时间 | c(CO)/mol?L-1 | C(H2)/mol?L-1 | c(CH3OH)/mol?L-1 |
| 起始 | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.2 |
| 第4min | 0.4 | 1.8 | 0.6 |
| 第6min | 0.4 | 1.8 | 0.6 |
| A、第2min时,如果只改变某一条件,则改变的条件可能是降低温度 |
| B、第4min至第6 min该化学反应处于平衡状态 |
| C、第2min时,如果只改变某一条件,则改变的条件可能是使用催化剂 |
| D、第6min时,其他条件不变,如果升高温度,正逆反应速率均增大 |
已知下列反应:Cu+2Fe3+═Cu2++2Fe2+.现取Cu与Fe2O3的混合物22.4g与过量的稀硫酸反应.若要使固体混合物完全溶解,且所消耗的H2SO4的物质的量最少,则混合物中铜的质量为( )
| A、3.2g | B、6.4g |
| C、9.6g | D、12.8g |
化学与生活密切相关,下列说法正确的是( )
| A、聚乙烯塑料不会造成环境污染 |
| B、煤经过气化和液化等物理变化可转化为清洁燃料 |
| C、通过蒸发可从海水中提取溴、碘、镁 |
| D、利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 |
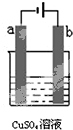 如图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )
如图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )| A、a电极的产物有Cu和H2 |
| B、反应一段时间后,溶液的pH值变小 |
| C、a电极附近呈红色,b电极附近出现蓝色 |
| D、a、b电极转移的电子数为0.8mol |
 某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)═CuSO4+H2↑.请画出能够实验这一反应的装置图.
某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)═CuSO4+H2↑.请画出能够实验这一反应的装置图.