题目内容
关于如图所示装置的叙述,正确的是( )


| A、氢离子在铜片表面被还原 |
| B、铜片质量逐渐减少 |
| C、电流从锌片经导线流向铜片 |
| D、铜是阳极,铜片上有气泡产生 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该装置构成原电池,锌易失电子作负极、Cu作正极,负极反应式为Zn-2e-=Zn2+,正极反应式为2H++2e-=H2↑,电流从正极沿导线流向负极,据此分析解答.
解答:
解:该装置构成原电池,锌易失电子作负极、Cu作正极,负极反应式为Zn-2e-=Zn2+,正极反应式为2H++2e-=H2↑,
A.铜片上氢离子得电子发生还原反应,被还原,故A正确;
B.铜片不参加反应,且铜片上生成氢气,所以铜片质量不变,故B错误;
C.电流从正极铜沿导线流向负极锌,故C错误;
D.铜是正极,故D错误;
故选A.
A.铜片上氢离子得电子发生还原反应,被还原,故A正确;
B.铜片不参加反应,且铜片上生成氢气,所以铜片质量不变,故B错误;
C.电流从正极铜沿导线流向负极锌,故C错误;
D.铜是正极,故D错误;
故选A.
点评:本题考查原电池原理,侧重考查学生对基本知识、基本理论的理解,注意原电池和电解池电极名称区别,题目难度不大.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目
13g锌与硝酸溶液反应,共消耗了31.5g硝酸,则硝酸的还原产物是( )
| A、只有N2O |
| B、NH4NO3或N2O |
| C、只有NO |
| D、只有N2 |
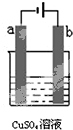 如图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )
如图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )| A、a电极的产物有Cu和H2 |
| B、反应一段时间后,溶液的pH值变小 |
| C、a电极附近呈红色,b电极附近出现蓝色 |
| D、a、b电极转移的电子数为0.8mol |
下列对于电化学说法正确的是( )
| A、为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 |
| B、电解精炼铜时,阳极泥中常含有金属金、银、锌等 |
| C、可充电电池放电时,化学能转变为电能 |
| D、铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
下列关于焰色反应的说法正确的是( )
| A、只有金属化合物才有焰色反应 |
| B、焰色反应是化学变化 |
| C、透过蓝色钴玻璃观察钾元素焰色反应的颜色为紫色 |
| D、每次焰色反应实验后都要将铂丝蘸取盐酸或硝酸洗涤并灼烧,铂丝可用铁丝来代替 |
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A、0.1mol?L-1 AlC13溶液中:H+、Na+、Cl-、SO42- |
| B、含有0.1mol?L-1 Fe3+的溶液中:Na+、K+、SCN-、NO3- |
| C、使甲基橙变红色的溶液中:Fe2+、K+、NO3-、SO42- |
| D、由水电离产生的c(H+)=10-12 mol?L-1的溶液中:NH4+、SO42-、HCO3-、Cl- |