题目内容
 在25℃时,用0.125mol?L-1的标准盐酸滴定25.00mL未知浓度的NaOH溶液所得滴定曲线如图所示,图中K点代表的pH为( )
在25℃时,用0.125mol?L-1的标准盐酸滴定25.00mL未知浓度的NaOH溶液所得滴定曲线如图所示,图中K点代表的pH为( )| A、13 | B、12 | C、10 | D、11 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:K点为免疫进入盐酸溶液时氢氧化钠溶液的pH,根据图象可知,25.00mL未知浓度的NaOH溶液中进入20mL 0.125mol?L-1的标准盐酸时,溶液的pH=7,两溶液恰好反应,根据酸碱中和反应的实质可知:n(HCl)=n(NaOH),据此计算出氢氧化钠溶液的浓度,然后根据水的离子积计算出NaoH溶液中氢离子浓度及溶液的pH.
解答:
解:25mL NaOH溶液中进入20mL 0.125mol?L-1的盐酸,混合液的pH=7,两溶液恰好反应,则n(HCl)=n(NaOH),
即:c(NaOH)×0.025L=0.125mol/L×0.02L,
解得:c(NaOH)=0.1mol/L,
该氢氧化钠溶液中氢氧根离子浓度为0.1mol/L,
则该氢氧化钠溶液中氢离子浓度为:
mol/L=1×10-13mol/L,
该溶液的pH=-lg1×10-13=13,
所以K点氢氧化钠溶液的pH为13,
故选A.
即:c(NaOH)×0.025L=0.125mol/L×0.02L,
解得:c(NaOH)=0.1mol/L,
该氢氧化钠溶液中氢氧根离子浓度为0.1mol/L,
则该氢氧化钠溶液中氢离子浓度为:
| 1×10-14 |
| 0.1 |
该溶液的pH=-lg1×10-13=13,
所以K点氢氧化钠溶液的pH为13,
故选A.
点评:本题考查了中和滴定曲线、溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法,明确中和滴定曲线中K点的含义为解答本题的关键.

练习册系列答案
相关题目
已知下列反应:Cu+2Fe3+═Cu2++2Fe2+.现取Cu与Fe2O3的混合物22.4g与过量的稀硫酸反应.若要使固体混合物完全溶解,且所消耗的H2SO4的物质的量最少,则混合物中铜的质量为( )
| A、3.2g | B、6.4g |
| C、9.6g | D、12.8g |
化学与生活密切相关,下列说法正确的是( )
| A、聚乙烯塑料不会造成环境污染 |
| B、煤经过气化和液化等物理变化可转化为清洁燃料 |
| C、通过蒸发可从海水中提取溴、碘、镁 |
| D、利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 |
下列说法不正确的是( )
| A、动态平衡状态在自然界和工农业生产中很少见 |
| B、化学反应的速率和限度均可通过改变相应的化学反应条件而改变 |
| C、物质发生化学反应都伴随着能量变化 |
| D、化学反应达到平衡状态时,正反应速率与逆反应速率相等 |
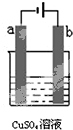 如图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )
如图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )| A、a电极的产物有Cu和H2 |
| B、反应一段时间后,溶液的pH值变小 |
| C、a电极附近呈红色,b电极附近出现蓝色 |
| D、a、b电极转移的电子数为0.8mol |
下列物质受光照射时,不会发生化学反应的是( )
| A、H2和Cl2混合 |
| B、H2和O2混合 |
| C、氯水 |
| D、AgBr |
 某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)═CuSO4+H2↑.请画出能够实验这一反应的装置图.
某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)═CuSO4+H2↑.请画出能够实验这一反应的装置图.