题目内容
14.已知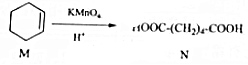 ,下列有关说法中正确的是( )
,下列有关说法中正确的是( )| A. | M中所有碳原子均位于同一平面,且与苯互为同系物 | |
| B. | 与N含有相同官能团的同分异构体共有8种 | |
| C. | M能发生加成反应和取代反应 | |
| D. | N与乙醇发生酯化反应,生成物的分子式一定为C8H14O4 |
分析 A.有机物含有饱和碳原子和碳碳双键,不含苯环;
B.可作为C4H10的2个H被-COOH取代;
C.M含有碳碳双键,可发生加成反应,也可发生取代反应;
D.N含有2个羧基,可与部分或完全酯化.
解答 解:A.有机物含有饱和碳原子,具有甲烷的结构特点,则所有碳原子不在同一个平面上,不含苯环,不是同系物,故A错误;
B.可作为C4H10的2个H被-COOH取代,C4H10有正丁烷、异丁烷两种,二取代物共9种,故B错误;
C.M含有碳碳双键,可发生加成反应,也可发生取代反应,如关照条件下可与氯气发生取代反应,故C正确;
D.N含有2个羧基,可与部分或完全酯化,故D错误.
故选C.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把握有机物的结构和官能团的性质,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列说法正确的是( )
| A. | 16gO2占有的体积约为11.2L | |
| B. | 22.4LH2含有阿伏加德罗常数个氢分子 | |
| C. | 在标准状况下,44.8LH2O的质量约为36g | |
| D. | 11gCO2与标准状况下5.6LHCl含有相同的分子数 |
5.浮选凝聚法处理酸性污水的工作原理如图所示,下列说法不正确的是( )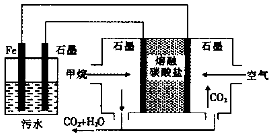

| A. | Fe电极的电极反应式为:Fe-2e-═Fe2+ | |
| B. | 通入空气的石墨电极的电极反应式为O2+2CO2+4e-═2CO32- | |
| C. | 通入甲烷的石墨电极的电极反应式为:CH4+100H+-8e-═CO32-+7H2O | |
| D. | 为增强污水的导电能力,可向污水中加入适量工业用食盐 |
2.25℃时,将某强酸和强碱溶液按10:1 的体积比混合后溶液恰好呈中性,则混合前强酸和强碱溶液的pH之和为( )
| A. | 9 | B. | ll | C. | 13 | D. | 15 |
9.下列事实或现象及结论均正确的是( )
| 选项 | 事实或现象 | 结论 |
| A | 某钾盐中滴加盐酸,产生使澄清石灰水变浑浊的无色气体 | 该钾盐是K2CO3或KHCO3 |
| B | 由淀粉得到葡萄糖 | 发生了水解反应 |
| C | 常温下,向相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中的铝片先溶解完 | 反应物的浓度越大,反应速率越快 |
| D | NH3沸点低于PH3 | 结构和组成相似的物质,沸点随相对分子质量增大而升高 |
| A. | A | B. | B | C. | C | D. | D |
6.下列能达到实验目的是( )
| A. |  分离甘油和水 分离甘油和水 | B. |  用工业酒精制取无水酒精 用工业酒精制取无水酒精 | ||
| C. |  制取MgCl2固体 制取MgCl2固体 | D. |  检测蔗糖与浓硫酸反应产生的CO2 检测蔗糖与浓硫酸反应产生的CO2 |
13.某烯烃与H2加成后的产物为 ,则该烯烃的结构简式可能有( )
,则该烯烃的结构简式可能有( )
 ,则该烯烃的结构简式可能有( )
,则该烯烃的结构简式可能有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
14.A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含哲同种元素.

已知:(I)A为金属单质;B为红褐色固体;E为密度最小的气体;G为浅绿色溶液.
(Ⅱ)D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀.
(Ⅲ)D能将某种氧化物氧化为F,F是含有三种元素的化合物.
请回答下列问题:
(1)上述反应中属于置换反应的是②⑤(填序号).
( 2)反应③(即D将某种氧化物氧化为F的离子方程式:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(3)D与氨水反应生成B的离子方程式:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(4)实验室制取C的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
对气体C进行如下实验.已知整个反应过程中,每消耗0.1moI KI,转移的电子数约为3.612×l023个.请按照要求填空:

已知:(I)A为金属单质;B为红褐色固体;E为密度最小的气体;G为浅绿色溶液.
(Ⅱ)D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀.
(Ⅲ)D能将某种氧化物氧化为F,F是含有三种元素的化合物.
请回答下列问题:
(1)上述反应中属于置换反应的是②⑤(填序号).
( 2)反应③(即D将某种氧化物氧化为F的离子方程式:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(3)D与氨水反应生成B的离子方程式:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(4)实验室制取C的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
对气体C进行如下实验.已知整个反应过程中,每消耗0.1moI KI,转移的电子数约为3.612×l023个.请按照要求填空:
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成蓝色 | Cl2+2I-=I2+2Cl-(用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=2HIO3+10HCl(用化学方程式表示) |