题目内容
10.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3(s)+3H2(g)$\stackrel{高温}{?}$W(s)+3H2O(g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应吸热(填“吸热”或“放热”).
(3)用H2还原WO2也可以得到金属钨.已知:
WO2(s)+2H2(g)═W(s)+2H2O(g);△H=+66.0kJ•mol-1
WO2(g)+2H2═W(s)+2H2O(g);△H=-137.9kJ•mol-1
则WO2(s)═WO2(g)的△H=+203.9 kJ•mol-1.
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:
W(s)+2I2(g)$?_{约3000℃}^{1400℃}$WI4(g).
下列说法正确的有a、b.
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意固体、纯液体不需要写出;
(2)由反应方程式知,消耗的H2与生成的水的物质的量相等,假定H2与水蒸气的物质的量分别为2mol、3mol,再根据转化率定义计算;
随温度的升高,H2与水蒸气的体积比减小,说明平衡向正反应移动,据此判断;
(3)观察所给三个热化学方程式知,用前一个已知热化学方程式减去后一个已知热化学方程式就可以得到WO2(s)?WO2(g),反应热也进行相应的运算;
(4)由化学方程式知,挥发的W与I2结合形成气态WI4,由于气体运动的结果,WI4会与还没有挥发的W接触,在高温下WI4分解生成的W附着在还没有挥发的W上,灯管壁温度较低,WI4不会分解,升高温度,正逆反应速率都加快,据此解答.
解答 解:(1)WO3(s)+3H2(g)$\stackrel{高温}{?}$ W(s)+3H2O(g)的平衡常数k=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$,故答案为:$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$;
(2)由反应方程式知,消耗的H2与生成的水的物质的量相等,故H2的平衡转化率为$\frac{3mol}{2mol+3mol}$×100%=60%,
升高温度,H2与水蒸气的体积比减小,说明升温时平衡向右移动,故正反应为吸热反应,
故答案为:60%;吸热;
(3)已知:①WO2 (s)+2H2 (g)?W (s)+2H2O (g);△H=+66.0kJ•mol-1
②WO2 (g)+2H2?W (s)+2H2O (g);△H=-137.9kJ•mol-1
①-②得则WO2 (s)?WO2 (g),故△H=66.0kJ•mol-1-(-137.9kJ•mol-1)=+203.9 kJ•mol-1,
故答案为:+203.9 kJ•mol-1;
(4)由所给化学方程式知,挥发的W与I2结合形成气态WI4,由于气体运动的结果,WI4会与还没有挥发的W接触,在高温下WI4分解生成的W及I2,生成W附着在还没有挥发的W上,灯管内的I2可循环使用,故a、b对;灯管壁温度较低,WI4不会分解,故c错;升高温度,也能加快W与I2的反应速率,故d错,
故答案为:a、b.
点评 本题考查较为综合,涉及化学平衡常数的书写、反应热的计算、化学平衡移动原理、化学平衡计算等,为高考常见题型,题目选择的素材比较陌生,以考查学生的能力为主,难度中等.

 优等生题库系列答案
优等生题库系列答案下列叙述Ⅰ和叙述Ⅱ均正确并且有因果关系的是( )
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | S2-具有还原性 | S2-能除去工业废水中的Cu2+等重金属离子 |
B | NH3具有还原性 | 蘸有浓硝酸的玻璃棒靠近浓氨水时冒白烟 |
C | 熔融状态的Al2O3中有自由移动的Al3+和O2- | 电解熔融状态的Al2O3制备Al |
D | SO2具有漂白性 | SO2能使紫色石蕊试液先变红后褪色 |
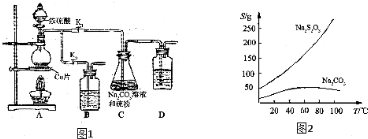
 工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:
工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:| 时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
(1)Q<0(填“>”、“=”或“<”).
(2)可以判断该反应达到化学平衡状态的叙述是CD(填字母).
A.单位时间内减少 CO(g) 的浓度等于生成 CO2(g) 的浓度
B.反应容器内的压强不发生变化
C.混合气体中 H2(g) 的浓度不再发生改变
D.氢气的生成速率等于水的生成速率
(3)若在850℃时向反应容器中充入H2O(g),K值不变(填“增大”、“减小”或“不变”).
(4)表中c2为0.18mol/L.
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)830℃,在1L的固定容器的密闭容器中放入1mol CO和5mol H2O,反应达平衡后,其化学平衡常数K等于1.0(填“大于”、“小于”或“等于”)
(4)830℃,容器中的反应达到平衡.在其他条件不变的情况下,扩大容器的体积,平衡不移动.(填“向正方向”、“向逆方向”或“不”)
(5)若1200℃时,在某时刻该容器中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向(选填“正反应方向”、“逆反应方向”、“不移动”).
| A. | 相同条件下,2 mol SO2(g)和1 mol O2(g)的键能之和大于2 mol SO3(g)的键能 | |
| B. | 如将一定量的SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2 mol SO2(g)被氧化 | |
| C. | 增大压强或升高温度,该平衡都向逆反应方向移动 | |
| D. | 将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
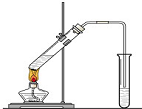 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题: