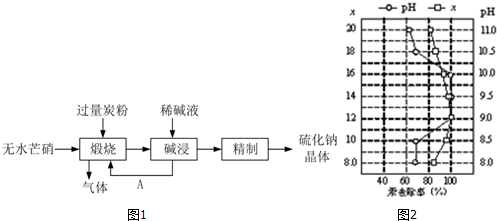
题目内容
2.Na2S2O3可做分析试剂.它易溶于水,遇酸易分解.某研究小组进行如下实验:【实验一】Na2S2O3•5H2O的制备
I 实验原理:Na2SO3(aq)+S(s)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq)
II 实验装置:如图1所示,有关物质的溶解度曲线如图2所示:
III 实验步骤:
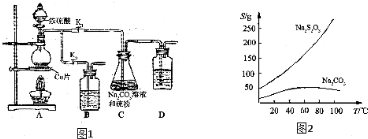
(1)检查装置气密性,按图1所示加入试剂,其中装置B和D中加的是NaOH溶液,装置 C中的硫粉应事先研细并用乙醇润湿,否则会影响降低反应速率(或会减少产量).
(2)打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热,烧瓶内发生反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.
(3)当C中溶液的pH接近7时,打开K2、关闭K1并停止加热.采取该措施的理由是防止SO2过量,溶液呈现酸性,导致生成的Na2S2O3分解.
(4)将C中的混合液过滤,将滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、烘干,可得粗产品Na2S2O3•5H2O.
IV 产品检测:
(5)粗产品中可能含有Na2SO3、Na2SO4等杂质,利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质.
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
【实验二】自来水中余氯的测定
含氯消毒剂给自来水消毒后有余氯.测定自来水中余氯含量的方案如下:在250mL碘量瓶中(或具塞锥形瓶中)放置0.5g碘化钾,加10mL稀硫酸,准确量取流动水样100mL(打开自来水龙头,待水流数十秒后再取水样)置于碘量瓶,迅速塞上塞摇动,见水样呈淡黄色,加1ml淀粉溶液变蓝,则说明水样中有余氯.再以C mol/L标准Na2S2O3溶液滴定,至溶液蓝色消失呈无色透明溶液,记下硫代硫酸钠溶液的体积.
(已知:滴定时反应的化学方程式为I2+2Na2SO3═2NaI+Na2S4O6)
(6)若该自来水是以漂白粉消毒,能说明水样中有余氯的反应离子方程式为ClO-+2I-+2H+=Cl-+I2+H2O.
(7)按上述方案实验,消耗标准Na2S2O3溶液V mL,该次实验测得自来水样品中余氯量(以游离Cl2计算)为355VCmg•L-1.在上述实验过程中,若“塞上塞摇动”动作不够迅速,则测得结果偏高(填“偏高”“偏低”或“不变”).
分析 (1)B和D是为了吸收多余的二氧化硫,可以用NaOH溶液吸收;把硫研细,增大接触面积,加快反应速率,S微溶于酒精,所以C中的硫粉应事先研细并用乙醇润湿,否则会降低反应速率;
(2)烧瓶内铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
(3)防止SO2过量,溶液呈现酸性,导致生成的Na2S2O3分解;
(4)从滤液中获得Na2S2O3•5H2O时,不能直接加热蒸干,否则无法获得Na2S2O3•5H2O,需要通过蒸发浓缩、冷却结晶的操作方法;
(5)取少量产品溶于足量稀盐酸,再利用氯化钡溶液检验是否含有了酸根离子;
(6)漂白粉的有效成分是次氯酸根,次氯酸根检验强氧化性,可以将碘离子氧化得碘单质,自身被还原为氯离子;
(7)根据Cl2~I2~2Na2S2O3计算余氯量,动作不迅速,空气中的氧气在酸性条件下可把碘离子氧化生成单质碘,消耗硫代硫酸钠的体积会增大.
解答 解:(1)B和D是为了吸收多余的二氧化硫,所以装的是NaOH溶液;把硫研细,增大接触面积,加快反应速率,S微溶于酒精,所以C中的硫粉应事先研细并用乙醇润湿,否则会降低反应速率,
故答案为:NaOH溶液;降低反应速率(或会减少产量);
(2)打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热,烧瓶内生成二氧化硫气体,发生反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)SO2过量,溶液呈现酸性,导致生成的Na2S2O3分解,
故答案为:防止SO2过量,溶液呈现酸性,导致生成的Na2S2O3分解;
(4)从滤液中获得Na2S2O3•5H2O,不能直接蒸干,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、烘干等操作,
故答案为:蒸发浓缩、冷却结晶;
(5)检验样品中是否含有硫酸钠的方案为:取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质,
故答案为:取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质;
(6)漂白粉的有效成分是次氯酸根,次氯酸根检验强氧化性,可以将碘离子氧化得碘单质,自身被还原为氯离子,反应离子方程式为:ClO-+2I-+2H+=Cl-+I2+H2O,
故答案为:ClO-+2I-+2H+=Cl-+I2+H2O;
(7)根据Cl2~I2~2Na2S2O3,可知n(Cl2)=$\frac{1}{2}$n(Na2S2O3)=$\frac{1}{2}$×V×10-3L×Cmol/L,氯气质量为=$\frac{1}{2}$×V×10-3L×Cmol/L×71g/mol=3.55VC×10-2g=35.4VC mg,故余氯量(以游离Cl2计算)为 $\frac{35.5VCmg}{0.1L}$=355VC mg/L;
动作不迅速,空气中的氧气在酸性条件下可把碘离子氧化生成单质碘,消耗硫代硫酸钠的体积会增大,所以结果偏高,
故答案为:355VC;偏高.
点评 本题考查制备方案的设计,题目难度中等,涉及对操作的分析评价、尾气吸收、方程式的书写、离子的检验、化学计算等知识,明确实验原理为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析能力及化学实验能力.

 阅读快车系列答案
阅读快车系列答案| 温度/°C | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的平衡常数表达式K=$\frac{c(C)c(D)}{c(A)c(B)}$,△H<0(填“<”“>”“=”);
(2)830°C时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol•L-1•s-1,则6s时c(A)=0.022mol•L-1,C的物质的量为0.09mol;若反应经一段时间后,达到平衡时A的转化率为80%
(3)判断该反应是否达到平衡的依据为c(填正确选项前的字母);
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200°C时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为2.5.
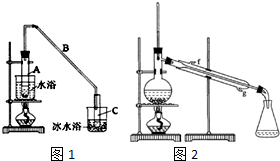 某化学小组采用类似乙酸乙酯的装置如图1:以环己醇制备环己烯.
某化学小组采用类似乙酸乙酯的装置如图1:以环己醇制备环己烯.已知:
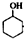 $→_{85℃}^{稀H_{2}SO_{4}}$
$→_{85℃}^{稀H_{2}SO_{4}}$ +H2O
+H2O| 密度(g.cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.096 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.081 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
③浓H2SO4在反应中的作用催化剂、脱水剂.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入蒸馏水,振荡、静置、分层,环己烯在上 层(填上或下).
②再将环己烯按图2装置蒸馏,冷却水从g (填入编号)口进入.蒸馏时要加入生石灰的目的除去了残留的水.
(3)以下可以鉴别环己烯和环己醇的物质有bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.溴水.
| A. | 2NO2 (g)?N2O4(g)△H<0 | B. | C(s)+CO2 (g)?2CO(g)△H>0 | ||
| C. | N2(g)+3H2 (g)?2NH3(g)△H<0 | D. | H2S (g)?H2 (g)+S(s)△H>0 |
| A. | 容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液 | |
| B. | 配制一定物质的量浓度的稀盐酸时,用量筒量取9.82 mL浓盐酸 | |
| C. | 配制1 L 0.1 mol•L-1的NaCl溶液时用托盘天平称量5.85 g NaCl固体 | |
| D. | 定容时,为防止液滴飞溅,胶头滴管紧贴容量瓶内壁 |
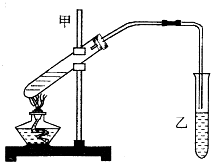 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.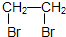 .
.