题目内容
15.某化学活动小组设计以下装置进行不同的实验.其中a为用于鼓入空气的气囊,b 为螺旋状铜丝,c中盛有冰水.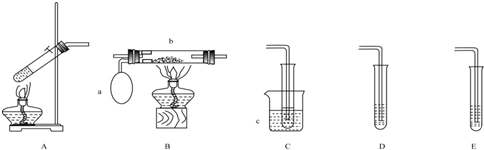
(1)若用A装置做乙醇与乙酸的酯化反应实验,则还需连接的装置是D(填序号),该装置中应加入试剂是饱和碳酸钠溶液.A中反应的化学方程式为:CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOC2H5+H2O
(2)该小组同学欲做乙醇氧化成乙醛的实验并收集生成的产物,则应选用的装置是ABC(填序号),反应的化学方程式为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O.
分析 (1)若用A装置做乙醇与乙酸的酯化反应实验,需要连接D装置吸收乙醇,中和乙酸,降低乙酸乙酯溶解度,防止倒吸;A装置液体加热沸腾需要加入碎瓷片/沸石防止暴沸;
(2)做乙醇氧化成乙醛的实验,需要提供乙醇蒸气和氧气在催化剂作用下氧化反应生成乙醛,冷却得到液体乙醛.
解答 解:(1)若用A装置做乙醇与乙酸的酯化反应实验,需要连接D装置,不能用连接E,防止倒吸,加入饱和碳酸钠溶液,吸收乙醇,中和乙酸,降低乙酸乙酯溶解度,防止倒吸;A装置液体加热沸腾需要加入碎瓷片/沸石,防止暴沸,A中发生反应为CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:D;饱和碳酸钠溶液;CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(2)做乙醇氧化成乙醛的实验,需要提供乙醇蒸气和氧气在催化剂作用下氧化反应生成乙醛,反应的化学方程式为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,冷却得到液体乙醛装置连接为A、B、C,
故答案为:A、B、C;2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O.
点评 本题考查了实验制备和物质性质验证的方法,为高频考点,侧重于学生的分析能力和实验能力的考查,掌握乙醇催化氧化原理和产物性质是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20. 图是实验室制乙酸乙酯的装置.
图是实验室制乙酸乙酯的装置.
(1)加热前,通常需要在试管Ⅰ中加入碎瓷片,目的是防止暴沸.
(2)为了证明浓硫酸的作用,某同学进行了以下4个实验,实验记录如表:
①为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴酚酞试液,每次实验结束后可观察到试管Ⅱ中的现象是液体分层,上层呈无色,下层呈红色.
②分析实验A、B、C的数据,可以得出浓硫酸在反应中的作用是催化剂、吸水剂;实验D和实验C对照,你又能得出的结论是对该反应起催化作用的实际上为H+.
(3)饱和Na2CO3溶液的作用是中和乙酸、溶解乙醇、降低酯在水中的溶解度,容易分层.
 图是实验室制乙酸乙酯的装置.
图是实验室制乙酸乙酯的装置.(1)加热前,通常需要在试管Ⅰ中加入碎瓷片,目的是防止暴沸.
(2)为了证明浓硫酸的作用,某同学进行了以下4个实验,实验记录如表:
| 实验 编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL3mol•L-1硫酸 | 饱和Na2CO3溶液 | 1.2 |
| D | 3mL乙醇、2mL乙酸、6mL6mol•L-1盐酸 | 饱和Na2CO3溶液 | 1.2 |
②分析实验A、B、C的数据,可以得出浓硫酸在反应中的作用是催化剂、吸水剂;实验D和实验C对照,你又能得出的结论是对该反应起催化作用的实际上为H+.
(3)饱和Na2CO3溶液的作用是中和乙酸、溶解乙醇、降低酯在水中的溶解度,容易分层.
2.蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制取碱式碳酸镁的实验步骤如图所示:
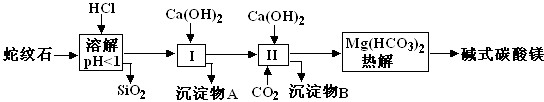
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是Fe3+、Al3+(填离子符号).
(2)进行Ⅰ操作时,控制溶液的pH=7-8(有关氢氧化物沉淀的pH见下表)Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3(填化学式,下同)溶解、,Mg(OH)2沉淀.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入NaOH或Ca(OH)2 溶液,然后过滤、洗涤、灼烧 (依次填写实验操作名称).
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是CaCO3或CO2.
(5)现设计一个实验,确定产品aMgCO3•bMg(OH)2•cH2O中a、b、c的值,请完成下列实验步骤(可用试剂:浓硫酸、碱石灰):
Ⅰ.①称量样品,②高温分解,③用浓硫酸吸收水蒸气,④称量碱石灰吸收CO2前后的质量,⑤称出MgO.
Ⅱ.18.2g产品完全分解后,产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中:a=3,b=1,c=3.

(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是Fe3+、Al3+(填离子符号).
(2)进行Ⅰ操作时,控制溶液的pH=7-8(有关氢氧化物沉淀的pH见下表)Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3(填化学式,下同)溶解、,Mg(OH)2沉淀.
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.3 | 3.3 | 9.4 |
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是CaCO3或CO2.
(5)现设计一个实验,确定产品aMgCO3•bMg(OH)2•cH2O中a、b、c的值,请完成下列实验步骤(可用试剂:浓硫酸、碱石灰):
Ⅰ.①称量样品,②高温分解,③用浓硫酸吸收水蒸气,④称量碱石灰吸收CO2前后的质量,⑤称出MgO.
Ⅱ.18.2g产品完全分解后,产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中:a=3,b=1,c=3.
2. 将10mL淀粉胶体和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图所示)2min后,分别取袋内和烧杯内液体进行实验.下列说法正确的是( )
将10mL淀粉胶体和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图所示)2min后,分别取袋内和烧杯内液体进行实验.下列说法正确的是( )
 将10mL淀粉胶体和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图所示)2min后,分别取袋内和烧杯内液体进行实验.下列说法正确的是( )
将10mL淀粉胶体和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图所示)2min后,分别取袋内和烧杯内液体进行实验.下列说法正确的是( )| A. | 烧杯内液体加入硝酸银溶液后有白色沉淀产生 | |
| B. | 烧杯内液体加入碘水后呈蓝色 | |
| C. | 袋内液体加入硝酸银溶液后不会出现白色沉淀 | |
| D. | 袋内液体加入碘水后不变蓝 |

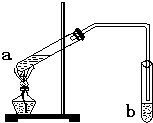 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.请回答下列问题:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.请回答下列问题: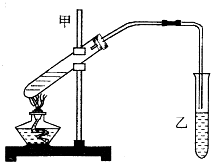 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.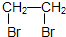 .
.