题目内容
19.锡及其化合物在生产、生活中有着重要的用途.已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33℃、沸点为114℃.
请按要求回答下列相关问题:
(1)锡在周期表中的位置为第五周期第ⅣA族.
(2)用于镀锡工业的硫酸亚锡(SnSO4)的制备步骤如下:
I.SnCl2加入盐酸和Sn 粉
II.分离滤渣和滤液
Ⅲ.滤液用NaHCO3调节pH至6~7 得混合物(含SnO)
Ⅳ.从混合物中分离得SnO
V.SnO和稀硫酸最终得SnSO4晶体
①步骤Ⅰ加入Sn粉的作用:防止Sn 2+被氧化为Sn4+及调节溶液pH.
②步骤Ⅱ用到的玻璃仪器有烧杯、漏斗、玻璃棒.
③步骤Ⅲ生成SnO的离子方程式:Sn2++2HCO3-=SnO↓+2CO2↑+H2O.
④步骤Ⅳ中检验SnO是否洗涤干净的操作是取最后一次洗涤后滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀,证明已洗净.
⑤步骤Ⅴ操作依次为蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥.
(3)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl.
实验室欲用如图装置制备少量SnCl4 (夹持装置略),该装置存在明显缺陷,改进方法是在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶;熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行.
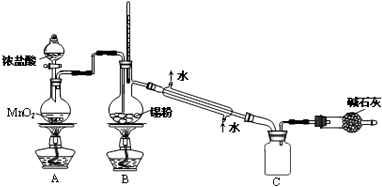
(4)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是熔融锡与氯气化合的反应是放热反应,且放出的热足够使此反应持续进行.
(5)用于微电子器件生产的锡粉纯度测定:
①取2.38g试样溶于较浓硫酸中(杂质不参与反应),使Sn完全转化为Sn2+
②加入过量的Fe2(SO4)3
③用0.1000mol•L-1K2Cr2O7溶液滴定,消耗20.00mL,
步骤②中加入Fe2(SO4)3的作用是:将Sn 2+全部氧化为Sn 4+;此锡粉样品中锡的质量分数:30%.
分析 (1)主族元素原子核外电子层数与其周期数相等,最外层电子数与其族序数相等;
(2)I.SnCl2是强酸弱碱盐,Sn2+易水解且易被氧化,为防止水解和氧化,SnCl2加入盐酸和Sn 粉;
II.分离滤渣和滤液采用过滤方法;
Ⅲ.滤液用NaHCO3调节pH至6~7 得混合物(含SnO),Sn2+和NaHCO3发生双水解反应Sn2++2HCO3-=SnO↓+2CO2↑+H2O生成SnO;
Ⅳ.采用过滤方法将混合物中分离得SnO;
V.SnO和稀硫酸最终得SnSO4晶体,反应方程式为SnO+H2SO4=SnSO4+H2O;
(3)SnCl4蒸气遇氨及水汽呈浓烟状,说明SnCl4、NH3、H2O反应生成氯化铵和Sn(OH)4;
(4)熔融锡与氯气化合的反应是放热反应,且放出的热足够使此反应持续进行;SnCl4易水解,制备中应在干燥环境中进行;
(5)Fe2(SO4)3将Sn2+全部氧化为Sn4+,同时生成Fe2+,根据元素守恒及电子得失守恒有关系式3Sn~3Sn2+~6Fe3+~6Fe2+~K2Cr2O7,根据K2Cr2O7的物质的量可计算出锡的物质的量,进而求得锡的质量,据此确定锡的质量分数.
解答 解:(1)Sn原子核外有5个电子层、最外层电子数是5,所以位于第五周期、第ⅣA族,故答案为:第五周期第ⅣA族;
(2)①Sn2+易水解且易被氧化,为防止水解和氧化,SnCl2加入盐酸和Sn 粉,所以Sn的作用是防止Sn 2+被氧化为Sn4+和调节溶液的pH,
故答案为:防止Sn 2+被氧化为Sn4+;
②步骤II是过滤,用到的玻璃仪器有漏斗、玻璃棒和烧杯,故答案为:漏斗(或普通漏斗)、玻璃棒;
③该反应离子方程式为Sn2++2HCO3-=SnO↓+2CO2↑+H2O,故答案为:Sn2++2HCO3-=SnO↓+2CO2↑+H2O;
④如果沉淀有吸附的离子,应该是氯离子,实验室用硝酸酸化的硝酸银检验氯离子,其检验方法为取最后一次洗涤后滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀,
故答案为:取最后一次洗涤后滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀;
⑤从溶液中获取晶体采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥的方法,故答案为:蒸发浓缩、冷却结晶;
(3)SnCl4水解得到Sn(OH)4与HCl,HCl与氨气反应得到NH4Cl,反应方程式为:SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;
由于SnCl4易水解,制备中应在干燥环境中进行,制备的氯气中含有HCl、水蒸气,需要除去,防止Sn与HCl反应,SnCl4水解,改进方法是:在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶;
熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行,
故答案为:SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶;熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行;
(4)熔融锡与氯气化合的反应是放热反应,且放出的热足够使此反应持续进行,所以不需要外加热源,
故答案为:熔融锡与氯气化合的反应是放热反应,且放出的热足够使此反应持续进行;
(5)Fe2(SO4)3将Sn2+全部氧化为Sn4+,同时生成Fe2+,反应的离子方程式为2Fe3++Sn2+=2Fe2++Sn4+,根据元素守恒及电子得失守恒有关系式3Sn~3Sn2+~6Fe3+~6Fe2+~K2Cr2O7,K2Cr2O7的物质的量为0.1000mol•L-1×0.02L=0.002mol,所以锡的物质的量为0.006mol,则锡的质量分数为$\frac{0.003mol×119g/mol}{2.38g}$×100%=30%,
故答案为:将Sn 2+全部氧化为Sn 4+;30%.
点评 本题考查物质制备,为高频考点,涉及化学反应方程式的计算、离子检验、实验评价、化学工艺流程等知识点,明确元素化合物性质、物质分离提纯方法、离子检验方法等知识点是解本题关键,会正确利用转移电子守恒判断(5)题关系式,题目难度中等.

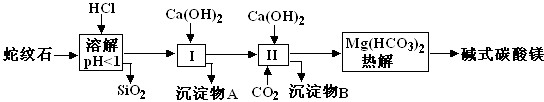
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是Fe3+、Al3+(填离子符号).
(2)进行Ⅰ操作时,控制溶液的pH=7-8(有关氢氧化物沉淀的pH见下表)Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3(填化学式,下同)溶解、,Mg(OH)2沉淀.
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.3 | 3.3 | 9.4 |
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是CaCO3或CO2.
(5)现设计一个实验,确定产品aMgCO3•bMg(OH)2•cH2O中a、b、c的值,请完成下列实验步骤(可用试剂:浓硫酸、碱石灰):
Ⅰ.①称量样品,②高温分解,③用浓硫酸吸收水蒸气,④称量碱石灰吸收CO2前后的质量,⑤称出MgO.
Ⅱ.18.2g产品完全分解后,产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中:a=3,b=1,c=3.
| A. | 2NO2 (g)?N2O4(g)△H<0 | B. | C(s)+CO2 (g)?2CO(g)△H>0 | ||
| C. | N2(g)+3H2 (g)?2NH3(g)△H<0 | D. | H2S (g)?H2 (g)+S(s)△H>0 |
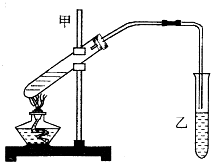 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O. .
.
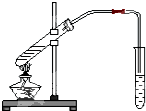 如图为实验室制乙酸乙酯的装置.
如图为实验室制乙酸乙酯的装置.