题目内容
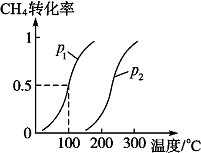 将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应Ⅱ:CH4(g)+H2O(g)?CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图.
将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应Ⅱ:CH4(g)+H2O(g)?CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图.(1)已知100℃、p1时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
(2)图中的p1
(3)100℃时平衡常数为
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)根据图知道平衡时甲烷的转化率,求出△c(CH4),根据v=
计算v(CH4),利用速率之比等于化学计量数之比计算v(H2).
(2)根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时甲烷的转化率,由此判断;由图可知,温度越高甲烷的转化率越大,即升高温度平衡向正反应方向移;
(3)平衡常数k=
,计算出平衡时,各组分的浓度,代入平衡常数计算.
| △c |
| △t |
(2)根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时甲烷的转化率,由此判断;由图可知,温度越高甲烷的转化率越大,即升高温度平衡向正反应方向移;
(3)平衡常数k=
| c(CO)c3(H2) |
| c(CH4)×c(H2O) |
解答:
解:(1)由图知道平衡时甲烷的转化率为0.5,所以△c(CH4)
=0.005mol/L,
所以v(CH4)=
=0.001mol/(L?min),速率之比等于化学计量数之比,所以v(H2)=3v(CH4)=3×0.001mol/(L?min)=0.003mol/(L?min).
故答案为:0.003mol/(L?min);
(2)温度相同时,作垂直x轴的辅助线,发现压强为P1的CH4的转化率高,反应为前后体积增大的反应,压强增大平衡向体积减小的方向移动,即向逆反应移动,CH4的转化率降低,所以P1<P2,由图可知,温度越高甲烷的转化率越大,即升高温度平衡向正反应方向移,温度升高平衡向吸热方向移动,所以正反应为吸热反应,即△H>0,
故答案为:<;>;
(3)CH4(g)+H2O(g)?CO(g)+3H2(g),
开始(mol):1.0 2.0 0 0
变化(mol):1.0×0.5 0.5 0.5 1.5
平衡(mol):0.5 1.5 0.5 1.5
所以平衡常数k=
=
=2.25×10-4,
故答案为:2.25×10-4.
| 1.0mol×0.5 |
| 100L |
所以v(CH4)=
| 0.005mol/L |
| 5min |
故答案为:0.003mol/(L?min);
(2)温度相同时,作垂直x轴的辅助线,发现压强为P1的CH4的转化率高,反应为前后体积增大的反应,压强增大平衡向体积减小的方向移动,即向逆反应移动,CH4的转化率降低,所以P1<P2,由图可知,温度越高甲烷的转化率越大,即升高温度平衡向正反应方向移,温度升高平衡向吸热方向移动,所以正反应为吸热反应,即△H>0,
故答案为:<;>;
(3)CH4(g)+H2O(g)?CO(g)+3H2(g),
开始(mol):1.0 2.0 0 0
变化(mol):1.0×0.5 0.5 0.5 1.5
平衡(mol):0.5 1.5 0.5 1.5
所以平衡常数k=
| c(CO)c3(H2) |
| c(CH4)×c(H2O) |
| ||||
|
故答案为:2.25×10-4.
点评:本题考查了化学平衡计算应用,反应速率,平衡常数概念的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
一定温度下,在2L的密闭容器中加入4molA和6molB,发生如下反应:2A(g)+3B(g)?4C(g)+D(g)反应10min后达平衡,此时D的浓度为0.5mol/L.下列说法正确的是( )
| A、前10min反应的平均速率V(C)=0.10mol/L?min |
| B、10min后向容器中加入A,重新平衡时A的转化率一定大于50% |
| C、恒温下将反应容器体积缩小一半,则D的平衡浓度小于1.0mol/L |
| D、反应达平衡时B的平衡浓度是1.5mol/L |
(1)P和S (2)Mg和Ca (3)Al和Si三组原子中,分别找出第一电离能较高的原子,这三种原子的原子序数之和是( )
| A、40 | B、48 | C、41 | D、49 |
下列各项叙述中,类比推理正确的是( )
| A、铜丝在氧气中燃烧生成是CuO,则铁丝在氧气中燃烧生成Fe2O3 |
| B、少量CO2通入NaOH溶液中生成Na2CO3,则少量CO2通入C6H5ONa溶液中也生成Na2CO3 |
| C、甲醛能发生银镜反应,则甲酸甲酯也能发生银镜反应 |
| D、金刚石的硬度大,则C60的硬度也大 |
