题目内容
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的离子化学方程式:
C+ MnO4-+ H+→ CO2↑+ Mn2+ H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验1中以v (CO2) 表示的反应速率为 (取小数二位,下同).
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= .
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol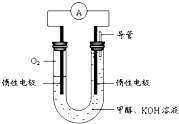
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(4)甲醇被称为21世纪的新型燃料,近几年开发的甲醇燃料电池的工作原理如图.
通入O2的电极为 极(填电极名称),写出甲醇阴极的电极反应
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为 .
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的离子化学方程式:
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/molm] | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②该反应为
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol

写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(4)甲醇被称为21世纪的新型燃料,近几年开发的甲醇燃料电池的工作原理如图.
通入O2的电极为
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为
考点:化学平衡的计算,氧化还原反应方程式的配平,用盖斯定律进行有关反应热的计算,原电池和电解池的工作原理,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:(1)反应中C元素的化合价由0升高为+4价,Mn元素的化合价由+7价降低为+2价,结合化合价升降总数相等以及元素守恒配平;
(2)①依据化学平衡三段式列式结合化学反应速率计算;
②计算实验1、2达到平衡的平衡常数比较判断反应进行的方向;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(4)甲醇燃料电池,甲醇在负极失电子发生氧化反应碱溶液中生成碳酸盐,正极氧气得到电子生成氢氧根离子;
(5)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)?c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
(2)①依据化学平衡三段式列式结合化学反应速率计算;
②计算实验1、2达到平衡的平衡常数比较判断反应进行的方向;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(4)甲醇燃料电池,甲醇在负极失电子发生氧化反应碱溶液中生成碳酸盐,正极氧气得到电子生成氢氧根离子;
(5)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)?c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
解答:
解:(1)反应中C元素的化合价由0升高为+4价,Mn元素的化合价由+7价降低为+2价,该反应中转移20e-,由电子守恒和元素守恒定律可知:碳和二氧化碳前系数为5,高锰酸钾和硫酸锰化学式前为4,得离子反应为5C+4MnO4-+12H+=5CO2↑+4Mn2++6H2O,
故答案为:5;4;12;5;4;6;
(2)①依据化学平衡三段式列式计算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol) 4 2 0 0
变化量(mol) 1.6 1.6 1.6 1.6
平衡量(mol) 2.4 0.4 1.6 1.6
所以以v (CO2) 表示的反应速率=
=0.13mol/(L?min);
故答案为:0.13mol/(L?min);
②实验1 CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 2 1 0 0
变化量(mol/L) 0.8 0.8 0.8 0.8
平衡量(mol/L) 1.2 0.2 0.8 0.8
K1=
=2.7
实验2 CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 1 0.5 0 0
变化量(mol/L) 0.2 0.2 0.2 0.2
平衡量(mol/L) 0.8 0.3 0.2 0.2
K2=
=0.17
温度升高,平衡常数减小,说明平衡逆向进行,逆向是吸热反应,正反应方向是放热反应;
故答案为:放热;0.17;
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
依据盖斯定律①-②+③×4得到2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l)△H=-442.8 kJ∕mol;
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ∕mol;
(4)甲醇燃料电池,甲醇在负极失电子发生氧化反应碱溶液中生成碳酸盐,即CH3OH-6e-+8OH-=CO32-+6H2O,正极上是氧气得到电子生成氢氧根离子,
故答案为:正; CH3OH-6e-+8OH-=CO32-+6H2O;
(5)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=
×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)?c(Ca2+)=2.8×10-9可知,c(Ca2+)=
mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L.
故答案为:5.6×10-5.
故答案为:5;4;12;5;4;6;
(2)①依据化学平衡三段式列式计算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol) 4 2 0 0
变化量(mol) 1.6 1.6 1.6 1.6
平衡量(mol) 2.4 0.4 1.6 1.6
所以以v (CO2) 表示的反应速率=
| ||
| 6min |
故答案为:0.13mol/(L?min);
②实验1 CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 2 1 0 0
变化量(mol/L) 0.8 0.8 0.8 0.8
平衡量(mol/L) 1.2 0.2 0.8 0.8
K1=
| 0.8×0.8 |
| 1.2×0.2 |
实验2 CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 1 0.5 0 0
变化量(mol/L) 0.2 0.2 0.2 0.2
平衡量(mol/L) 0.8 0.3 0.2 0.2
K2=
| 0.2×0.2 |
| 0.8×0.3 |
温度升高,平衡常数减小,说明平衡逆向进行,逆向是吸热反应,正反应方向是放热反应;
故答案为:放热;0.17;
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
依据盖斯定律①-②+③×4得到2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l)△H=-442.8 kJ∕mol;
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ∕mol;
(4)甲醇燃料电池,甲醇在负极失电子发生氧化反应碱溶液中生成碳酸盐,即CH3OH-6e-+8OH-=CO32-+6H2O,正极上是氧气得到电子生成氢氧根离子,
故答案为:正; CH3OH-6e-+8OH-=CO32-+6H2O;
(5)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=
| 1 |
| 2 |
| 2.8×10-9 |
| 1×10-4 |
故答案为:5.6×10-5.
点评:本题考查了氧化还原反应配平,原电池原理的分析判断,化学平衡影响因素和平衡常数的计算方法,热化学方程式计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
近期,北京,珠三角近相继出现了PM2.5大范围超标的情况.科学家用PM2.5表示每立方米空气中这种颗粒的含量,这个值越高,就代表空气污染越严重,对人身体的健康危害越大.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物,汽车尾气、冬天供暖锅炉烟气排放、工厂的烟气排放、低温无风天气的持续导致PM2.5持续走高.下列有关说法中正确的是:( )
(1)大量关闭化工生产企业
(2)PM2.5专用口罩使用了活性炭,是利用了活性炭的吸附性
(3)上述颗粒物可产生丁达尔效应
(4)杜绝能源的开采
(5)燃放烟花爆竹会产生PM2.5;
(6)PM2.5是造成灰霾天气的“元凶”之一;
(7)PM2.5的颗粒大小与分子大小差不多.
(1)大量关闭化工生产企业
(2)PM2.5专用口罩使用了活性炭,是利用了活性炭的吸附性
(3)上述颗粒物可产生丁达尔效应
(4)杜绝能源的开采
(5)燃放烟花爆竹会产生PM2.5;
(6)PM2.5是造成灰霾天气的“元凶”之一;
(7)PM2.5的颗粒大小与分子大小差不多.
| A、(1)(2)(3)(7) |
| B、(2)(3)(5)(7) |
| C、(2)(5)(6) |
| D、(2)(3)(4)(5)(7) |
在MgCl2、KCl、K2SO的混合溶液中,若K+为0.8mol,Cl-为1.3mol,Mg2+为0.5mol,则SO42-的物质的量为( )
| A、0.1mol |
| B、0.5mol |
| C、0.15mol |
| D、0.25mol |
 根据要求完成下列各小题实验目的.(如图a、b为弹簧夹,加热及固定装置已略去)
根据要求完成下列各小题实验目的.(如图a、b为弹簧夹,加热及固定装置已略去)