题目内容
19.H2S在O2中不完全燃烧生成S和H2O,下列说法中正确的是( )| A. | 微粒半径:O2->S2- | B. | 还原性:H2S<H2O | ||
| C. | 稳定性:H2S<H2O | D. | 电离方程式:H2S?2H++S2- |
分析 A.离子的电子层越多,离子半径越大;
B.H2S在O2中不完全燃烧生成S和H2O,S失去电子,H2S为还原剂;
C.根据O的非金属性比S强判断;
D.H2S为弱酸应该分布电离.
解答 解:A.离子的电子层越多,离子半径越大,则离子半径为O2-<S2-,故A错误;
B.H2S在O2中不完全燃烧生成S和H2O,S失去电子,H2S为还原剂,由还原剂的还原性大于还原产物的还原性可知,还原性:H2S>H2O,故B错误;
C.因为O的非金属性比S强,所以稳定性:H2S<H2O,故C正确;
D.H2S为弱酸应该分布电离,电离方程式:H2S?H++HS-,故D错误;
故选C.
点评 本题以氧化还原反应为载体考查微粒性质、电离方程式书写等,为高频考点,把握反应中元素的化合价变化及规律性知识的应用为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 14g C2H4和C3H6的混合物中,所含原子的总数为3NA | |
| B. | 足量的Fe与2.24 L Cl2反应转移的电子数为0.2NA | |
| C. | 0.1 mol•L-1的MgCl2溶液中含Cl-的数目为0.2NA | |
| D. | 1.8g H218O中所含中子数为NA |
7.下列说法正确的是( )
| A. | 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 | |
| B. | 碘易升华,可用加热升华法除去NH4Cl混有的I2 | |
| C. | 铁在硫蒸气中燃烧生成Fe2S3 | |
| D. | 在过氧化钠与水的反应,毎生成0.1mol氧气,转移电子的数目为0.2NA |
14.丙烯是一种常见的有机物.下列有关丙烯的化学用语中,不正确的是( )
| A. | 实验式 CH2 | B. | 结构简式 CH2=CHCH3 | ||
| C. | 球棍模型 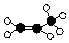 | D. | 聚合后的结构简式 |
4.为了从海带浸取液中提取碘,某同学设计了如图实验方案:下列说法正确的是( )


| A. | ①中反应的离子方程式:2I-+H2O2═I2+2OH- | |
| B. | ②中分液时含I2的CCl4溶液从分液漏斗上口倒出 | |
| C. | ③中得到的上层溶液中含有I- | |
| D. | 操作Z的名称是加热 |
11.2016年10月长征二号火箭成功将神州十一号载人飞船送入太空,实现了我国宇航员中期在轨驻留.火箭使用的液体推进剂是偏二甲肼[(CH3)2N-NH2]和N2O4,发生如下化学反应:C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(g)△H<0.关于该反应的说法不正确的是( )
| A. | N2O4做氧化剂 | |
| B. | C2H8N2中有两种元素被氧化 | |
| C. | 消耗1 mol C2H8N2时,产生201.6 L气体 | |
| D. | 消耗等量燃料时,生成液态水比生成气态水放出的热量多 |
8.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池,以下说法错误的是( )
| A. | Mg作电池负极,发生氧化反应 | |
| B. | 正极反应式为:AgCl+e-=Ag+Cl- | |
| C. | 放电时Cl-由负极向正极迁移 | |
| D. | 当负极质量减轻4.8g,电路中通过0.4mol电子 |
9.根据:2Fe3++2I-=2Fe2++I2;Br2+2Fe2+=2Fe3++2Br-两个反应,判断Fe3+、I2、Br2的氧化性顺序为( )
| A. | I2>Fe3+>Br2 | B. | Br2>I2>Fe3+ | C. | Br2>Fe3+>I2 | D. | Fe3+>Br2>I2 |