题目内容
10.如图是氮循环示意图,请回答下列问题.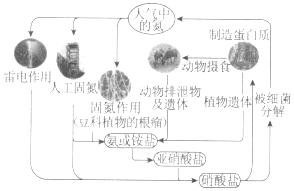
①自然界中的固氮和人工固氮的共同点是将氮元素由游离态转化为化合态.
②雷电固氮反应的化学方程式是N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,其中氮元素被氧化(填“氧化”或“还原”).
③根据循环图判断下列说法不正确的是a.
a.氮元素均被氧化
b.工业合成氨属于人工固氮
c.含氮无机物和含氮有机物可相互转化
d.碳、氢、氧三种元素也参与了氮循环.
分析 ①氮的固定是游离态氮元素变化为化合态氮元素;
②雷电固氮反应是氮气和氧气放电反应生成一氧化氮,氮元素被氧化;
③a.氮的循环中铵盐或铵变化为亚硝酸盐的过程中氮元素被还原;
b.人工固氮是利用工业生产合成氨;
c.上述转化关系可知含氮无机物可以转化为蛋白质;
d.碳、氢、氧三种元素也参加了氮循环,如大气中的氮气转化氮的氧化物,氧元素参与,转化为铵盐,氢元素参加.
解答 解:①将氮元素由游离态转化为化合态氮元素的过程称为氮的固定,故答案为:化合态;
②放电条件下,氮气和氧气反应生成一氧化氮,反应方程式为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,氮元素化合价升高,被氧化,
故答案为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;氧化;
③a.碳、氢、氧三种元素也参与了氮循环,如硝酸盐中氮元素的化合价为+5价,被细菌分解变成大气中氮单质,氮元素由+5→0,属于被还原,故a错误;
b.工业合成氨是将N2与H2在一定条件下反应生成NH3,属于人工固氮,故b正确;
c.氮循环中铵盐和蛋白质可相互转化,铵盐属于无机物,蛋白质属于有机物,含氮无机物和含氮有机物可相互转化,故c正确;
d.碳、氢、氧三种元素也参加了氮循环,如蛋白质的制造需要碳元素,又如N2在放电条件下与O2直接化合生成无色且不溶于水的一氧化氮气体,N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,氧元素参与,二氧化氮易与水反应生成硝酸(HN03)和一氧化氮,3NO2+H2O=2HNO3+NO,氢元素参加,故d正确.
故答案为:a.
点评 本题主要考查了碳(氮)元素在自然界中的循环、氮(碳)以及化合物的性质,理解氧化还原反应、人工固氮等知识点是解答的关键,题目难度不大.

 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案| A. | 10g H2和10g O2 | B. | 5.6LN2(标准状况)和11gCO2 | ||
| C. | 9g H2O和1mol Br2 | D. | 224ml H2(标准状况)和0.1mol N2 |
| A. | 氢氧化钠的摩尔质量是40 g | |
| B. | 1 mol硫酸的质量是98g•mol-1 | |
| C. | 甲烷的摩尔质量就是它的相对分子质量 | |
| D. | 17 g NH3含N原子数是6.02×1023个 |
| A. | H2和O2反应生成水 | B. | CuO投入稀硫酸中 | ||
| C. | 高温煅烧石灰石制CO2 | D. | NaOH溶液和K2SO4溶液混合 |
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)表中元素原子半径最大的是(写元素符号)Si,Z原子核外电子能量最高的电子亚层是3p.
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式解释产生该现象的原因:CO32-+H2O?HCO3-+OH-;在上述红色的溶液中加入少许氯化钙固体,溶液颜色变浅,请用平衡理论解释产生该现象的原因Ca2++CO32-=CaCO3↓,导致溶液中碳酸根离子浓度减少,水解平衡向逆反应方向移动,氢氧根离子浓度减少,碱性减弱.
(4)硫酸工业生产中接触室内发生的反应方程式为2SO2+O2$?_{△}^{催化剂}$2SO3;在实际生产中,操作温度选定400-500℃、压强通常采用常压的原因分别是催化剂在400~500℃时,活性最大,在常压下及400~500℃时,二氧化硫的转化率已经很高,若加压会增加设备、投资和能量消耗.
| A. | 微粒半径:O2->S2- | B. | 还原性:H2S<H2O | ||
| C. | 稳定性:H2S<H2O | D. | 电离方程式:H2S?2H++S2- |
| A. | SO42- | B. | NO3- | C. | CH4 | D. | H2S |
 ,其中氮的化合价为-2;
,其中氮的化合价为-2;