题目内容
12.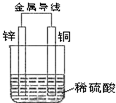 根据如图铜锌原电池示意图,回答下列问题:
根据如图铜锌原电池示意图,回答下列问题:(1)该原电池总离子反应式是Zn+2H+═Zn2++H2↑.
(2)外电路电流的方向是从Cu到Zn(填Zn到Cu或Cu到Zn).
(3)在电池的工作过程中,Zn极质量变化了3.25g,则Cu极质量不变
(填“增加”、“不变”或“减少”),电路中转移电子为0.1mol,铜表面析出了氢气1.12L(标准状况下).
分析 在原电池中较活泼的金属作负极,失电子发生氧化反应,电子经导线传递到正极,电流与电子运动方向相反,溶液中阳离子移向正极,阴离子移向负极,Zn比Cu活泼,Zn做负极电极反应式为:Zn-2e-=Zn2+,铜作正极,氢离子得电子,电极反应式为:2H++2e-═H2↑,总反应离子方程式为:Zn+2H+═Zn2++H2↑,根据电极反应式分析求解.
解答 解:在原电池中较活泼的金属作负极,失电子发生氧化反应,电子经导线传递到正极,电流与电子运动方向相反,溶液中阳离子移向正极,阴离子移向负极,Zn比Cu活泼,Zn做负极电极反应式为:Zn-2e-=Zn2+,铜作正极,氢离子得电子,电极反应式为:2H++2e-═H2↑,总反应离子方程式为:Zn+2H+═Zn2++H2↑,
(1)在原电池中,较活泼金属Zn做负极,电极反应式为:Zn-2e-=Zn2+,铜作正极,氢离子得电子,电极反应式为:2H++2e-═H2↑,总反应离子方程式为:Zn+2H+═Zn2++H2↑,
故答案为:Zn+2H+═Zn2++H2↑;
(2)在原电池中较活泼的金属作负极,不活泼金属作正级,负极失电子,电子经导线传递到正极,电流与电子运动方向相反,因为Zn比Cu活泼,Zn做负极,Cu作正极,所以电流方向是从Cu到Zn,
故答案为:Cu到Zn;
(3)由于正极是氢离子得到电子,所以Cu电极质量不变,根据电极反应式Zn-2e-=Zn2+,Zn极质量变化了3.25g,说明参加反应的锌为 $\frac{3.25g}{65g•mo{l}^{-1}}$=0.05mol,所以转移电子物质的量为:0.05mol×2=0.1mol,铜作正极,氢离子得电子,电极反应式为:2H++2e-═H2↑,2e-~H2,根据电子得失守恒可知:转移电子物质的量为0.1mol时,产生氢气0.05mol,在标况下所占体积为:0.05mol×22.4L•mol-1=1.12L,
故答案为:不变;0.1;1.12.
点评 本题考查了原电池的相关知识,注意原电池的形成条件、电子守恒,题目难度中等.

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案| A. | ${\;}_{53}^{127}$I与${\;}_{53}^{129}$I互为同位素 | |
| B. | Na+的结构示意图为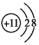 | |
| C. | 高氯酸(HClO4)中氯元素的化合价为+7 | |
| D. | I和Cl是同一主族元素,HI比HCl稳定 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 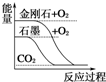 石墨转变成金刚石是吸热反应 | |
| B. | 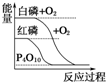 白磷比红磷稳定 | |
| C. | 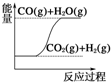 CO(g)+H2O(g)═CO2(g)+H2(g)△H>0 | |
| D. | 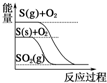 S(g)+O2(g)═SO 2(g)△H1 S(g)+O2((g)═SO2((g)△H2,则△H1>△H2 |
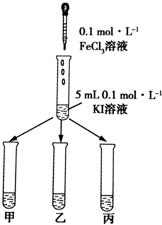 某学习小组通过下面的实验一和实验二,探究某些化学理论.
某学习小组通过下面的实验一和实验二,探究某些化学理论.实验一:以反应2Fe3++2I-=2Fe2++I2为例,
探究该反应是否为可逆反应.
实验方法:在KI溶液中滴加3mlFeCl3溶液,将混合液均
匀分到甲、乙、丙三支试管中;往试管甲中滴加淀粉
溶液,往试管乙中滴加KSCN溶液.如图所示:
(1)若试管甲中出现变蓝现象;
乙试管中出现血红色现象,
则说明该反应为可逆反应.
实验二:实验室制备CO2的反应.实验过程中的数据及相关信息如下表:
| 序号 | 反应温度/℃ | C(HCl)/mol•L-1 | V(HCl)/ml | 10g碳酸钙的形状 | t/min |
| ① | 20 | 2 | 10 | 块状 | t 1 |
| ② | 20 | 4 | 10 | 块状 | t 2 |
| ③ | 20 | 2 | 10 | 粉末 | t 3 |
| ④ | 40 | 2 | 10 | 粉末 | t 4 |
| ⑤ | 40 | 4 | 10 | 粉末 | t5 |
(2)由表格中的信息可知实验二的目的是探究影响化学反应速率的因素
(3)实验①和实验②是探究浓度对该化学反应速率的影响,分析表格中的信息可知,对该化学反应速率的影响因素还有温度、接触面积
(4)收集a ml CO2所需的时间最少的实验是⑤(填实验序号)
| A. |  +Cl2$\stackrel{光照}{→}$ +Cl2$\stackrel{光照}{→}$ +HCl +HCl | |
| B. | CH2=CH2+Br2→CH2BrCH2Br | |
| C. | ClCH2CH═CH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH═CH2+NaCl | |
| D. |  +HO-NO2$→_{△}^{浓硫酸}$ +HO-NO2$→_{△}^{浓硫酸}$ +H2O +H2O |
| A. | 热还原法 | B. | 电解法 | C. | 热分解法 | D. | 以上方法均不可 |
| A. | 原子半径:C、Al、K依次增大 | |
| B. | 热稳定性:HF、NH3、SiH4依次增大 | |
| C. | 水化物的酸碱性:NaOH、Al(OH)3、Mg(OH)2碱性减弱 | |
| D. | 非金属性:Cl、P、S依次增强 |
| A. | 该溶液中H+、Fe2+、C6H5OH、Br-可以大量共存 | |
| B. | 该溶液中滴入含0.1molNa0H的稀溶液的离子方程式为:3NH${\;}_{4}^{+}$+Fe3++6OH-═Fe(0H)3↓+3NH3↑+3H2O | |
| C. | 该溶液中加入足量Zn粉的离子方程式为:2Fe3++Zn═Zn2++2Fe2+ | |
| D. | 该溶液中加1L0.2mol/L Ba(0H)2溶液的离子方程式为:NH${\;}_{4}^{+}$+Fe3++2S0${\;}_{4}^{2-}$+2Ba2++4OH-═2BaSO4↓+Fe(OH)3↓+NH3•H2O |