题目内容
2.下列关于0.1mol NH4Fe(SO4)2•24H2O形成的溶液说法正确的是( )| A. | 该溶液中H+、Fe2+、C6H5OH、Br-可以大量共存 | |
| B. | 该溶液中滴入含0.1molNa0H的稀溶液的离子方程式为:3NH${\;}_{4}^{+}$+Fe3++6OH-═Fe(0H)3↓+3NH3↑+3H2O | |
| C. | 该溶液中加入足量Zn粉的离子方程式为:2Fe3++Zn═Zn2++2Fe2+ | |
| D. | 该溶液中加1L0.2mol/L Ba(0H)2溶液的离子方程式为:NH${\;}_{4}^{+}$+Fe3++2S0${\;}_{4}^{2-}$+2Ba2++4OH-═2BaSO4↓+Fe(OH)3↓+NH3•H2O |
分析 A.三价铁离子能够与苯酚发生显色反应;
B.三铁离子、氨根离子共存,加入氢氧化钠,氢氧化钠先与三价铁离子反应;
C.锌粉足量,二价铁离子被还原为铁;
D.NH4Fe(SO4)2•24H2O与Ba(0H)2按照物质的量之比为1:2反应,生成氢氧化铁、硫酸钡和一水合氨;
解答 解:A.NH4Fe(SO4)2•24H2O溶液中含有三价铁离子,三价铁离子能够与苯酚发生显色反应,不能共存,故A错误;
B.该溶液中滴入含0.1molNa0H的稀溶液的离子方程式为,氢氧根离子少量,只与三价铁离子反应,离子方程式:Fe3++3OH-=Fe(OH)3↓,故B错误;
C.锌粉足量,二价铁离子被还原为铁,故C错误;
D.该溶液中加1L0.2mol/L Ba(0H)2溶液的离子方程式为:NH4++Fe3++2S042-+2Ba2++4OH-═2BaSO4↓+Fe(OH)3↓+NH3•H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,离子反应遵循客观事实、遵循电荷守恒规律,注意反应物用量对反应的影响,题目难度中等.

练习册系列答案
相关题目
13.下列说法错误的是( )
| A. | 钠的金属性比镁强 | B. | 溴的非金属性比氯强 | ||
| C. | 硝酸的酸性比磷酸弱 | D. | 水的稳定性比氨强 |
14.下列物质中既能与盐酸反应,又能与氢氧化钠溶液反应的盐是( )
| A. | NaHCO3 | B. | Al(OH)3 | C. | SiO2 | D. | Fe2O3 |
11.下列关于糖类的说法中不正确的是( )
| A. | 淀粉、纤维素和蔗糖都属于糖类 | |
| B. | 麦芽糖和葡萄糖都属于单糖,不能再进一步水解 | |
| C. | 可以用新制的氢氧化铜检验病人尿液中是否含有葡萄糖 | |
| D. | 油脂是高级脂肪酸的甘油酯 |
12.如表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,X的氢化物与其最高价氧化物的水化物能直接反应生成盐.下列说法不正确的是( )
| X | Y | Z |
| W | ||
| T |
| A. | 单质X2与Y2在放电作用下不能直接反应得到XY2 | |
| B. | X2Y2易溶于H2Y是由于它们分子间存在氢键的缘故 | |
| C. | 非金属性:Z元素比W元素强;酸性:HZ比HW强 | |
| D. | TY2既具有氧化性,也具有还原性 |
 根据如图铜锌原电池示意图,回答下列问题:
根据如图铜锌原电池示意图,回答下列问题: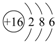 用电子式表示化合物 C2D 的形成过程
用电子式表示化合物 C2D 的形成过程