题目内容
7.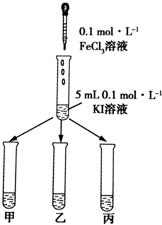 某学习小组通过下面的实验一和实验二,探究某些化学理论.
某学习小组通过下面的实验一和实验二,探究某些化学理论.实验一:以反应2Fe3++2I-=2Fe2++I2为例,
探究该反应是否为可逆反应.
实验方法:在KI溶液中滴加3mlFeCl3溶液,将混合液均
匀分到甲、乙、丙三支试管中;往试管甲中滴加淀粉
溶液,往试管乙中滴加KSCN溶液.如图所示:
(1)若试管甲中出现变蓝现象;
乙试管中出现血红色现象,
则说明该反应为可逆反应.
实验二:实验室制备CO2的反应.实验过程中的数据及相关信息如下表:
| 序号 | 反应温度/℃ | C(HCl)/mol•L-1 | V(HCl)/ml | 10g碳酸钙的形状 | t/min |
| ① | 20 | 2 | 10 | 块状 | t 1 |
| ② | 20 | 4 | 10 | 块状 | t 2 |
| ③ | 20 | 2 | 10 | 粉末 | t 3 |
| ④ | 40 | 2 | 10 | 粉末 | t 4 |
| ⑤ | 40 | 4 | 10 | 粉末 | t5 |
(2)由表格中的信息可知实验二的目的是探究影响化学反应速率的因素
(3)实验①和实验②是探究浓度对该化学反应速率的影响,分析表格中的信息可知,对该化学反应速率的影响因素还有温度、接触面积
(4)收集a ml CO2所需的时间最少的实验是⑤(填实验序号)
分析 (1)若证明反应2Fe3++2I-=2Fe2++I2为可逆反应需要证明溶液中同时存在铁离子和碘单质;
(2)图表数据分析可知实验目的是探究影响化学反应速率的因素,主要是温度、浓度、接触面积对化学反应速率的影响;
(3)实验①和实验②是盐酸浓度不同其他条件相同,浓度对反应速率的影响,除浓度外,温度、接触面积也会影响化学反应速率;
(4)①②③④⑤组实验中温度升高对反应速率影响大,从④⑤中选择反应速率最大的一组;
解答 解:(1)若证明反应2Fe3++2I-=2Fe2++I2为可逆反应需要证明溶液中同时存在铁离子和碘单质,在KI溶液中滴加3mlFeCl3溶液,将混合液均匀分到甲、乙、丙三支试管中;往试管甲中滴加淀粉溶液,往试管乙中滴加KSCN溶液,若试管甲中出现蓝色证明碘单质存在,乙试管中出现血红色溶液证明含铁离子,说明反应是可逆反应,
故答案为:蓝色;血红色;
(2)图表数据分析可知,①②③④⑤组实验目的是探究影响化学反应速率的因素,主要是温度、浓度、接触面积对化学反应速率的影响,改变一个条件,对化学反应速率影响,由表格中的信息可知实验二的目的是探究影响化学反应速率的因素,
故答案为:影响化学反应速率的因素;
(3)实验①和实验②是盐酸浓度不同其他条件相同,探究浓度对反应速率的影响,除浓度外,图表中温度、接触面积也会影响化学反应速率,
故答案为:浓度; 温度、接触面积;
(4)五组实验分析可知对化学反应速率影响大的是温度升高,温度越高反应速率越快,反应需要的时间越短,从④⑤组选择,第⑤组实验中盐酸浓度大,反应速率快所需时间短,
故答案为:⑤;
点评 本题考查了影响化学反应反应速率的因素分析判断,主要是温度、浓度、接触面积对反应速率影响数据的分析应用,掌握分析方法是解题关键,题目难度中等.

| A. | 盐酸 | B. | 稀硫酸 | C. | 氯气 | D. | 硫酸铜溶液 |
 某实验小组对一含有Al3+的未知溶液进行了如下分析:
某实验小组对一含有Al3+的未知溶液进行了如下分析:(1)滴入少量氢氧化钠,无明显变化;
(2)继续滴加NaOH溶液,有沉淀生成;
(3)滴入过量的氢氧化钠,白色沉淀明显减少.实验小组经定量分析,得出如图所示沉淀与滴入氢氧化钠体积的关系.下列说法错误的是( )
| A. | 该未知溶液中一定含有Al3+ Mg2+ H+三种阳离子 | |
| B. | 滴加的NaOH溶液的物质的量浓度为5 mol•L-1 | |
| C. | 若将最终沉淀过滤、洗涤、灼烧,其质量可能为6 g | |
| D. | 若另一种离子为二价阳离子,则a=10 |
 .
. 根据如图铜锌原电池示意图,回答下列问题:
根据如图铜锌原电池示意图,回答下列问题: