题目内容
2.下列说法不正确的是( )| A. | ${\;}_{53}^{127}$I与${\;}_{53}^{129}$I互为同位素 | |
| B. | Na+的结构示意图为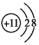 | |
| C. | 高氯酸(HClO4)中氯元素的化合价为+7 | |
| D. | I和Cl是同一主族元素,HI比HCl稳定 |
分析 A.质子数相同、中子数不同的原子互为同位素;
B.钠离子核内质子数为11,核外电子数为11,各层电子数为2、8、1;
C.根据化合价代数和为0计算;
D.非金属性越强,对应氢化物越稳定.
解答 解:A.12753I与12953I质子数均为53,质量数不同,互为同位素,故A正确;
B.钠离子核内质子数为11,核外电子数为10,结构示意图为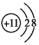 ,故B正确;
,故B正确;
C.根据化合价代数和为0,高氯酸(HClO4)中氯元素的化合价为+7,故C正确;
D.同主族自上而下非金属性减弱,氢化物稳定性减弱,即HCl比HI稳定,故D错误.
故选:D.
点评 本题考查同位素、原子结构示意图、化学式计算、元素周期律应用等,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
13.表为元素周期表的一部分,其中的编号代表所对应的元素.请回答下列问题:

(1)⑧号元素的基态原子的价电子排布式是3d84s2,与其同周期,且基态原子的核外未成对电子数最多的元素是Cr (写出元素符号).
(2)④号与⑦号元素形成的氧化物的熔点由高到低的是MgO>CaO.
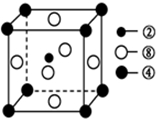
(3)①号与③号元素形成的含有18电子的分子为过氧化氢(写出名称),该分子中③号元素的原子的杂化方式为sp3.②、④、⑧三种元素的原子形成的晶体,其晶胞的结构特点如图所示,则该化合物的化学式为MgNi3C(用对应的元素符号表示).
(4)下表是某些短周期元素的电负性值:
①通过分析电负性值变化规律,确定N最接近的电负性值范围:2.5<N<3.5.
②推测电负性值与原子半径关系是半径越大,电负性值越小.
③试推断:AlBr3中化学键类型是共价键.

(1)⑧号元素的基态原子的价电子排布式是3d84s2,与其同周期,且基态原子的核外未成对电子数最多的元素是Cr (写出元素符号).
(2)④号与⑦号元素形成的氧化物的熔点由高到低的是MgO>CaO.
(3)①号与③号元素形成的含有18电子的分子为过氧化氢(写出名称),该分子中③号元素的原子的杂化方式为sp3.②、④、⑧三种元素的原子形成的晶体,其晶胞的结构特点如图所示,则该化合物的化学式为MgNi3C(用对应的元素符号表示).

(4)下表是某些短周期元素的电负性值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.1 |
②推测电负性值与原子半径关系是半径越大,电负性值越小.
③试推断:AlBr3中化学键类型是共价键.
10.下列关于热化学反应的描述中正确的是( )
| A. | NH4Cl 固体和Ba(OH)2晶体在常温下混合即可反应,是因为该反应是放热反应 | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热为△H=+566.0kJ/mol | |
| C. | 含1mol Ba(OH)2的溶液和含1molH2SO4的溶液反应放出的热量是中和热 | |
| D. | 1mol CH4燃烧生成水蒸气和二氧化碳所放出的热量是甲烷的燃烧热 |
7.aXn-和bYm+是由短周期元素形成的简单离子,已知Xn-比Ym+多两个电子层,下列说法正确的是( )
| A. | X只能是第三周期元素 | B. | Y不可能是第二周期元素 | ||
| C. | Y可能为氢元素 | D. | a-b+m+n等于10或20 |
14.在苯的同系物中加入少量酸性KMnO4溶液,振荡后褪色,正确的解释为( )
| A. | 苯的同系物分子中的碳原子数比苯分子中的碳原子数多 | |
| B. | 苯环受侧链影响易被氧化 | |
| C. | 侧链受苯环影响易被氧化 | |
| D. | 由于苯环和侧链的相互影响均易被氧化 |
11.下列比较中不正确的是( )
| A. | 金属性:K>Na>Li | B. | 热稳定性:HI>HCl>HF | ||
| C. | 非金属性:F>O>N | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
 根据如图铜锌原电池示意图,回答下列问题:
根据如图铜锌原电池示意图,回答下列问题: