题目内容
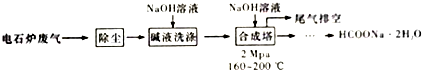
16.铜、银、金与社会生活联系密切,请回答下列相关问题.(1)在元素周期表中,铜、银、金元素位于同一族,它们基态原子的价层电子排布式中各能级上的电子数相等,能层数依次增大,其通式为(n-1)d10ns1(用n表示核外电子层数);铜元素所在周期中,基态原子未成对电子数最多的原子M的价层电子轨道示意图为
 .
.(2)银氨溶液可以检验醛基.
例如CH3CHO+2Ag(NH3)2OH→CH3COONH4+2Ag↓+3NH3+H2O.
①a个CH3CHO分子中π键的数目为a,碳原子轨道杂化类型为sp3、sp2.
②CH3CH2OH、CH3CHO的沸点分别为78.5℃、20.8℃,它们的相对分子质量相差2,而沸点却相差较大,其只要原因是CH3CH2OH分子之间形成氢键.
③在H、C、N、O中,第一电离能最大的元素和电负性最大的元素组成的化合物的化学式为N2O、NO、N2O3、NO2、N2O4、N2O5(填一种即可),CH4、NH3、H2O分子的键角依次减小,原因是分子中孤电子对数越多,键角越小,CH4、NH3、H2O分子中C、N、O的孤电子对数依次为0、1、2.
(3)金不溶于硝酸,但溶于“王水”,发生如下反应:
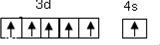
Au+4HCl+HNO3═H[AuCl4]+NO↑+2H2O,金溶于王水的主要原因是形成了[AuCl4]-,提高了金的活泼性.在[AuCl4]-中配位键的数目为4,写出该配离子的结构式:
 .
.(4)金、银的一种合金具有较强的储氢能力.该合金的晶胞为面心立方结构,银离子位于面心,金原子位于顶点.若该晶胞边长为acm,则晶胞的密度为$\frac{521}{{N}_{A}{a}^{3}}$g•cm-3.
(5)研究发现,金属阳离子在水溶液中的颜色与该金属阳离子d能级上的未成对电子数有关,已知溶液中Cu2+、Fe3+、Fe2+分别呈蓝色、棕黄色,浅绿色而Cu+呈无色,请解释该现象:Cu+d能级上的未成对电子数为0.Cu(OH)2难溶于氢氧化钠溶液,但是易溶于浓氨水,用离子方程式表示其主要原因:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O.
分析 (1)在元素周期表中,Cu、Ag、Au位于ⅠB族、各能级电子数相等价电子通式为(n-1)d10ns1,铜元素所在周期即为第四周期中,基态原子未成对电子数最多的原子为铬原子,据此答题;
(2)①CH3CHO中有碳氧双键,双键中有一个π键,根据碳原子周围的成键情况和孤电子对数可判断碳原子的杂化类型;
②分子形成氢键可以增大物质的熔沸点;
③在H、C、N、O中,第一电离能最大的元素为N,电负性最大的元素为O,根据价层电子对互斥理论,分子中孤电子对数越多,键角越小,据此答题;
(3)[AuCl4]-中,每个氯离子与金离子之间都形成一个配位键,据此可画出结构式;
(4)合金的晶胞为面心立方结构,银原子位于面心,金原子位于顶点,所以晶胞中银原子数为6×$\frac{1}{2}$=3,金原子数为8×$\frac{1}{8}$=1,根据$ρ=\frac{m}{V}$进行计算;
(5)金属阳离子在水溶液中的颜色与该金属阳离子d能级上的未成对电子数有关,Cu+的核外电子排布为[Ar]3d10,没有未成对的电子,铜离子能与氨分子形成铜氨络合离子,所以Cu(OH)2易溶于浓氨水,据此答题;
解答 解:(1)在元素周期表中,Cu、Ag、Au位于ⅠB族、各能级电子数相等价电子通式为(n-1)d10ns1,铜元素所在周期即为第四周期中,基态原子未成对电子数最多的原子为铬原子,其价层电子轨道示意图为 ,
,
故答案为:(n-1)d10ns1; ;
;
(2)①CH3CHO中有一个碳氧双键,双键中有一个π键,所以a个CH3CHO分子中π键的数目为a,根据碳原子周围的成键情况和孤电子对数可知,甲基中的碳的杂化方式为sp3,醛基中的碳原子的杂化方式为sp2,
故答案为:a;sp3、sp2;
②CH3CH2OH分子之间形成氢键,所以CH3CH2OH的沸点高于CH3CHO的沸点,
故答案为:CH3CH2OH分子之间形成氢键;
③在H、C、N、O中,第一电离能最大的元素为N,电负性最大的元素为O,它们组成的化合物的化学式为N2O、NO、N2O3、NO2、N2O4、N2O5,根据价层电子对互斥理论,分子中孤电子对数越多,键角越小,CH4、NH3、H2O分子中C、N、O的孤电子对数依次为0、1、2,所以CH4、NH3、H2O分子的键角依次减小,
故答案为:N2O、NO、N2O3、NO2、N2O4、N2O5;分子中孤电子对数越多,键角越小,CH4、NH3、H2O分子中C、N、O的孤电子对数依次为0、1、2;
(3)[AuCl4]-中,每个氯离子与金离子之间都形成一个配位键,所以有4个配位键,其结构式为 ,
,
故答案为:4; ;
;
(4)合金的晶胞为面心立方结构,银原子位于面心,金原子位于顶点,所以晶胞中银原子数为6×$\frac{1}{2}$=3,金原子数为8×$\frac{1}{8}$=1,根据$ρ=\frac{m}{V}$可知,晶胞的密度为$\frac{\frac{3×108+197}{{N}_{A}}}{{a}^{3}}$g/cm3=$\frac{521}{{N}_{A}{a}^{3}}$g/cm3,
故答案为:$\frac{521}{{N}_{A}{a}^{3}}$;
(5)金属阳离子在水溶液中的颜色与该金属阳离子d能级上的未成对电子数有关,Cu+的核外电子排布为[Ar]3d10,没有未成对的电子,铜离子能与氨分子形成铜氨络合离子,所以Cu(OH)2易溶于浓氨水,反应的离子方程式为Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu+d能级上的未成对电子数为0;Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O.
点评 本题考查较综合,涉及电子排布式、熔沸点的比较、氧化还原反应、晶胞的计算等知识点,根据密度公式、氧化还原反应原理等知识点来分析解答,难点是晶胞的计算,题目难度中等.

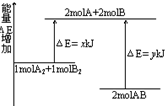
| A. | 该反应是吸热反应 | |
| B. | 断裂1molA-A键和1molB-B键共可放出xKJ能量 | |
| C. | 断裂1molA-B键需要吸收yKJ能量 | |
| D. | 1molA2和1molB2完全反应生产2molAB,放出(y-x)KJ能量 |
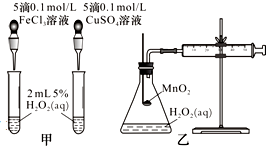 影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究.| 序号 | 温度/℃ | 催化剂 | 现象 | 结论 |
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 |
①实验1、2研究的是温度对H2O2分解速率的影响.
②实验2、3的目的是比较FeCl3溶液和MnO2两种催化剂对H2O2分解速率影响的差异.
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
①定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论.有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是控制阴离子相同,排除阴离子的干扰.
②定量分析:如图乙所示,实验时以收集到40mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是收集40mL气体所需时间.
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快.对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是放热反应,导致溶液温度升高,反应速率加快;
②从影响化学反应速率的因素看,你认为还可能是催化剂(Mn2+的催化作用)的影响.要证明你的猜想,实验方案是用两组酸性高锰酸钾溶液和草酸溶液作对比实验,一组加入少量MnSO4固体,一组不加,看反应速率快慢.
| A. | 氮气的电子式: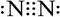 | B. | 镁离子的结构示意图: | ||
| C. | 中子数为16的磷原子:${\;}_{16}^{31}$P | D. | 丙烯的结构简式:CH3CHCH2 |
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2的熔点高于CH4 | 碳氧键键能大于碳氢键 |
| C | H2O的沸点高于H2S | H2O分子间形成了氢键 |
| D | 金刚石的硬度大于晶体硅 | 碳碳键键能大于硅硅键 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 元素 Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| B. | 元素 X与 W形成的共价化合物有很多种 | |
| C. | 元素 W、X的氯化物中,各原子均满足 8 电子的稳定结构 | |
| D. | 元素 Z 可与元素 X 形成共价化合物 XZ2 |

 .
.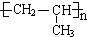 ,该反应类型是加聚反应.
,该反应类型是加聚反应. .
.