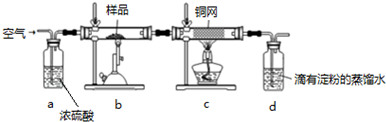
题目内容
6.短周期元素 W、X、Y 和Z的原子序数依次增大.W原子是半径最小的原子,非金属元素 X 形成的一种单质能导电,元素 Y 是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的 2 倍.下列说法错误的是( )| A. | 元素 Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| B. | 元素 X与 W形成的共价化合物有很多种 | |
| C. | 元素 W、X的氯化物中,各原子均满足 8 电子的稳定结构 | |
| D. | 元素 Z 可与元素 X 形成共价化合物 XZ2 |
分析 短周期元素 W、X、Y 和Z的原子序数依次增大.W原子是半径最小的原子,则W为H元素;元素 Y 是地壳中含量最丰富的金属元素,则Y为Al;非金属元素 X 形成的一种单质能导电,原子序数小于Al,则X为C;Z原子的最外层电子数是其电子层数的 2 倍,原子序数大于Al,处于第三周期,最外层电子数为6,故Z为S元素.
解答 解:短周期元素 W、X、Y 和Z的原子序数依次增大.W原子是半径最小的原子,则W为H元素;元素 Y 是地壳中含量最丰富的金属元素,则Y为Al;非金属元素 X 形成的一种单质能导电,原子序数小于Al,则X为C;Z原子的最外层电子数是其电子层数的 2 倍,原子序数大于Al,处于第三周期,最外层电子数为6,故Z为S元素.
A.Y为Al元素,Al与氢氧化钠溶液或盐酸反应均有氢气生成,故A正确;
B.C与H可以形成烷烃、烯烃、炔烃等,则元素X与W形成的共价化合物有很多种,故B正确;
C.元素W为H,X为C,二者的氯化物中,HCl中的H原子最外层只有2个电子,不满足8电子的稳定结构,故C错误;
D.元素S可与元素C形成共价化合物CS2,故D正确.
故选C.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解与应用,注意对基础知识的理解掌握.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
17. 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
(1)溴的价电子排布式为4s24p5;PCl3的空间构型为三角锥形
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
(3)根据表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘
(4)下列分子既不存在s-pσ键,也不存在p-pπ键的是D
A. HCl B.HF C. SO2 D. SCl2
(5)已知COCl2为平面形,则COCl2中心碳原子的杂化轨道类型为sp2杂化,写出CO的等电子体的微粒N2(写出1个).
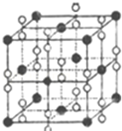
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是ρg•cm-3,则晶胞离得最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}×\root{3}{\frac{4×72}{ρ{N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA).
 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.(1)溴的价电子排布式为4s24p5;PCl3的空间构型为三角锥形
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
(3)根据表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
A. HCl B.HF C. SO2 D. SCl2
(5)已知COCl2为平面形,则COCl2中心碳原子的杂化轨道类型为sp2杂化,写出CO的等电子体的微粒N2(写出1个).
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是ρg•cm-3,则晶胞离得最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}×\root{3}{\frac{4×72}{ρ{N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA).
14.化学是材料科学发展的基础.下列说法正确的是( )
| A. | 可用作荧光灯内壁保护层的氧化铝纳米材料属于胶体 | |
| B. | 淀粉、纤维素和油脂都是天然高分子化合物 | |
| C. | 古代的陶瓷、砖瓦、现代的玻璃、水泥等,都是硅酸盐产品 | |
| D. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 |
11.下列5个有机化合物中,能够发生酯化、加成和氧化3种反应的是( )
①CH2=CHCOOH
②CH2=CHCOOCH3
③CH2=CHCH2OH
④CH3CH2CH2OH
⑤
①CH2=CHCOOH
②CH2=CHCOOCH3
③CH2=CHCH2OH
④CH3CH2CH2OH
⑤

| A. | ①③④ | B. | ②④⑤ | C. | ①③⑤ | D. | ①②⑤ |
18.历史上最早应用的还原性染料是靛蓝,其结构简式如图 .下列关于靛蓝的叙述中错误的是( )
.下列关于靛蓝的叙述中错误的是( )
 .下列关于靛蓝的叙述中错误的是( )
.下列关于靛蓝的叙述中错误的是( )| A. | 靛蓝由碳、氢、氧、氮四种元素组成 | B. | 它的分子式是C16H10N2O2 | ||
| C. | 该物质属于烃 | D. | 它是不饱和的有机物 |
15.下列有机物属于酚的是( )
| A. |  | B. |  | C. |  | D. |  |
16.下列物质既能使酸性高锰酸钾溶液褪色,又能使溴的四氯化碳溶液褪色的是( )
| A. | 甲苯 | B. | 苯 | C. | 2-丁炔 | D. | 聚乙烯 |
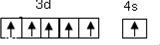 .
.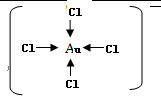 .
.