题目内容
1.化学反应A2+B2=2AB的能量变化如图所示.下列说法正确的是( )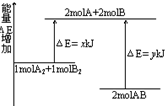
| A. | 该反应是吸热反应 | |
| B. | 断裂1molA-A键和1molB-B键共可放出xKJ能量 | |
| C. | 断裂1molA-B键需要吸收yKJ能量 | |
| D. | 1molA2和1molB2完全反应生产2molAB,放出(y-x)KJ能量 |
分析 A.根据反应物的能量高于生成物的能量时,反应是放热反应;
B.根据旧键的断裂吸收能量,新键的形成释放能量;
C.形成2molA-B键放出的能量与断裂2mol A-B键吸收的能量相等;
D.反应中能量变化=新键形成放出总能量-旧键断裂吸收总能量,据此进行计算.
解答 解:A,根据图象可知,反应物的总能量高于生成物的总能量,该反应是放热反应,故A错误;
B.旧键的断裂需要吸收能量,不是放出能量,则断裂1molA-A键和1molB-B键共可吸收xKJ能量,故B错误;
C.由图可知形成2molA-B键需要放出ykJ能量,因此断裂1mol A-B键需要吸收$\frac{1}{2}$ykJ的能量,故C错误;
D.根据图示可知,1molA2和1molB2完全反应生产2molAB放出的能量为:(y-x)kJ,故D正确;
故选D.
点评 本题考查了化学反应与能量变化的关系,题目难度不大,明确化学键断裂、形成过程中发生的能量变化为解答关键,注意掌握化学反应中能量变化的计算方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
11.1L含氢气和1,3-丁二烯的混合气体,其中1,3丁二烯的体积百分含量为x%.在一定条件下充分反应后,恢复到原来的状态,所得气体的体积为y升.则下列关系式中正确的是( )
| A. | y=x%<$\frac{1}{2}$ | B. | y=1-x%>$\frac{2}{3}$ | C. | y=x%>$\frac{1}{3}$ | D. | y=1-2x%>$\frac{1}{3}$ |
16.下列各化合物的命名正确的是( )
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | |
| B. | CH3COOCH2CH2OOCCH3 乙二酸二乙酯 | |
| C. | CH3CH2CH(OH)CH3 3-丁醇 | |
| D. | 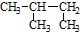 2-甲基丁烷 2-甲基丁烷 |
17. 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
(1)溴的价电子排布式为4s24p5;PCl3的空间构型为三角锥形
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
(3)根据表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘
(4)下列分子既不存在s-pσ键,也不存在p-pπ键的是D
A. HCl B.HF C. SO2 D. SCl2
(5)已知COCl2为平面形,则COCl2中心碳原子的杂化轨道类型为sp2杂化,写出CO的等电子体的微粒N2(写出1个).
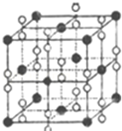
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是ρg•cm-3,则晶胞离得最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}×\root{3}{\frac{4×72}{ρ{N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA).
 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.(1)溴的价电子排布式为4s24p5;PCl3的空间构型为三角锥形
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
(3)根据表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
A. HCl B.HF C. SO2 D. SCl2
(5)已知COCl2为平面形,则COCl2中心碳原子的杂化轨道类型为sp2杂化,写出CO的等电子体的微粒N2(写出1个).
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是ρg•cm-3,则晶胞离得最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}×\root{3}{\frac{4×72}{ρ{N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA).
 .
. .
.