题目内容
8.肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa(25℃时)时,已知0.5mol液态肼与足量氧气反应,生成氮气和水蒸气,放出312KJ的热量.N2H4完全燃烧反应的热化学方程式是N2H4(1)+O2(g)=N2(g)+2H2O(g)△H=-624kJ/mol;又已知H2O(l)═H2O(g);△H=+44kJ?mol-1,由64g液态肼与氧气反应生成液态水时放出的热量是1424kJ.分析 根据题中数据计算出该反应的焓变,然后写出反应的热化学方程式;根据盖斯定律及题中热化学方程式计算出反应的热量.
解答 解:在101kPa(25℃时)时,已知0.5mol液态肼与足量氧气反应,生成氮气和水蒸气,放出312KJ的热量,则1mol液态肼完全反应生成氮气和水蒸气放出的热量为:312kJ×2=624kJ,该反应的热化学方程式为:N2H4(1)+O2(g)=N2(g)+2H2O(g)△H=-624kJ/mol;如果生成液态水,1mol肼完全反应放出的热量为:624kJ+44×2kJ=712kJ,64g液态肼完全反应生成氮气和液态水放出的热量为:712kJ×$\frac{64g}{32g/mol×1mol}$=1424kJ,
故答案为:N2H4(1)+O2(g)=N2(g)+2H2O(g)△H=-624kJ/mol;1424.
点评 本题考查了热化学方程式的书写及计算,题目难度中等,注意掌握电子式的概念及书写原则,明确热化学方程式的书写原则及反应热的计算方法.

练习册系列答案
 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
13.化学与科学、社会和人类生活密不可分,修订后的《中华人民共和国大气污染防治法》已于2016年1月1日起施行.下列有关大气污染防治说法错误的是( )
| A. | 开发新能源,如太阳能、风能等,减少对化石能源的依赖,也减少对大气的污染 | |
| B. | 农作物收割后留下的秸秆可以就地焚烧 | |
| C. | 实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境 | |
| D. | 汽油发动机工作时会产生少量NO和CO,采用催化反应装置可以减少污染物排放 |
20.2015年12月31日,日本获得第113号元素的正式命名权.这种原子(记作${\;}_{113}^{278}$Ja),是由30号元素Zn,连续轰击83号元素Bi获得的.下列说法,不正确的是( )
| A. | 获得新核素${\;}_{113}^{278}$Ja的过程,是一个化学变化 | |
| B. | 题中涉及的三种元素,都属于金属元素 | |
| C. | 这种超重核素${\;}_{113}^{278}$Ja的中子数与质子数只差为52 | |
| D. | 这种新核素,是同主族元素中原子半径最大的 |
17. 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
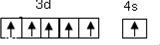
(1)溴的价电子排布式为4s24p5;PCl3的空间构型为三角锥形
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
(3)根据表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘
(4)下列分子既不存在s-pσ键,也不存在p-pπ键的是D
A. HCl B.HF C. SO2 D. SCl2
(5)已知COCl2为平面形,则COCl2中心碳原子的杂化轨道类型为sp2杂化,写出CO的等电子体的微粒N2(写出1个).
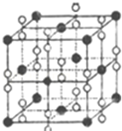
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是ρg•cm-3,则晶胞离得最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}×\root{3}{\frac{4×72}{ρ{N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA).
 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.(1)溴的价电子排布式为4s24p5;PCl3的空间构型为三角锥形
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
(3)根据表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
A. HCl B.HF C. SO2 D. SCl2
(5)已知COCl2为平面形,则COCl2中心碳原子的杂化轨道类型为sp2杂化,写出CO的等电子体的微粒N2(写出1个).
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是ρg•cm-3,则晶胞离得最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}×\root{3}{\frac{4×72}{ρ{N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA).
18.历史上最早应用的还原性染料是靛蓝,其结构简式如图 .下列关于靛蓝的叙述中错误的是( )
.下列关于靛蓝的叙述中错误的是( )
 .下列关于靛蓝的叙述中错误的是( )
.下列关于靛蓝的叙述中错误的是( )| A. | 靛蓝由碳、氢、氧、氮四种元素组成 | B. | 它的分子式是C16H10N2O2 | ||
| C. | 该物质属于烃 | D. | 它是不饱和的有机物 |
 .
. .
.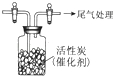 某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.
某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.