题目内容
9.体积为V mL、密度为ρ g•cm-3的溶液,含有相对分子质量为M的溶质m g,其物质的量浓度为c mol•L-1,溶质的质量分数为W%,下列表示式中不正确的是( )| A. | c=$\frac{W1000ρ}{M}$ | B. | m=$\frac{VρW}{100}$ | C. | W%=$\frac{CM}{1000ρ}$% | D. | c=$\frac{1000m}{VM}$ |
分析 A.根据物质的量浓度与溶质质量分数的关系c=$\frac{1000ρω}{M}$进行计算;
B.根据m=ρV计算出溶液质量,再根据m(溶质)=m(溶液)×ω计算出溶液中溶质的质量;
C.根据c=$\frac{1000ρω}{M}$计算出溶质质量分数进行计算;
D.根据物质的量浓度c=$\frac{n}{V}$计算出溶液的物质的量浓度.
解答 解:A.溶液的物质的量浓度为:c=$\frac{1000ρω}{M}$=$\frac{1000×ρ×W%}{M}$=$\frac{10ρW}{M}$,故A错误;
B.溶液的质量为:ρg•cm-3×VmL=ρVg,溶液中溶质的质量为:ρVg×W%=$\frac{VρW}{100}$g,故B正确;
C.根据c=$\frac{1000×ρ×W%}{M}$可得,溶质质量分数为:W%=$\frac{cM}{1000ρ}$,故C错误;
D.溶液中溶质的物质的量为:n=$\frac{m}{M}$mol,溶液的体积为:0.001VL,则该溶液的浓度为:c=$\frac{n}{V}$=$\frac{\frac{m}{M}mol}{0.001VL}$=$\frac{1000m}{VM}$mol/L,故D正确;
故选AC.
点评 本题考查了物质的量浓度、溶质质量分数的计算,题目难度中等,注意掌握物质的量浓度、溶质质量分数的表达式及计算方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
19.根据元素周期律和物质结构的有关知识,以下有关排序正确的是( )
| A. | 离子半径:Ca2+>Cl->S2- | B. | 第一电离能:Si>C>N | ||
| C. | 电负性:F>S>Mg | D. | 热稳定性:SiH4>H2S>H2O |
14.用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐相互反应,符合离子方程式2H++SO32-=H2O+SO2↑的反应个数有( )
| A. | 4个 | B. | 6个 | C. | 8个 | D. | 12个 |
1.下列关于金属Na的叙述中,说法正确的是( )
| A. | Na在常温下,与空气中的氧气不反应,所以Na不活泼 | |
| B. | Na在空气中燃烧,发出黄色火焰,产物是Na2O | |
| C. | Na是银白色金属,硬度大、熔点高 | |
| D. | Na应保存在煤油中 |
19.下列物质以任意比混合,只要混合物的质量不变,完全燃烧后产生CO2的质量也不变的是( )
| A. | 乙醛和乙酸乙酯 | B. | 甲酸和乙酸 | ||
| C. | 甲醛和乙醇 | D. | 甲酸甲酯和乙酸乙酯 |
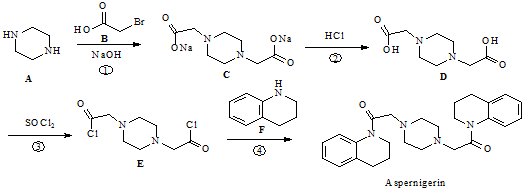
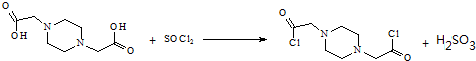
 )是临床上一种降脂抗血栓药物,它的一条合成路线如下:
)是临床上一种降脂抗血栓药物,它的一条合成路线如下:


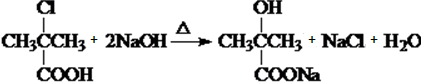 .
.
 .
.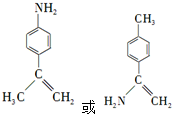 .
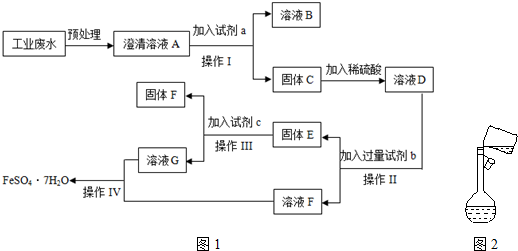
.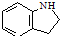 为原料,利用上述有关信息,写出制备
为原料,利用上述有关信息,写出制备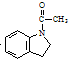 的合成路线流程图(无机试剂任用).合成路线流程图例如下:CH2═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH
的合成路线流程图(无机试剂任用).合成路线流程图例如下:CH2═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH .
.