题目内容
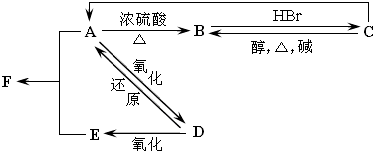
19.根据元素周期律和物质结构的有关知识,以下有关排序正确的是( )| A. | 离子半径:Ca2+>Cl->S2- | B. | 第一电离能:Si>C>N | ||
| C. | 电负性:F>S>Mg | D. | 热稳定性:SiH4>H2S>H2O |
分析 A.电子层结构相同,核电荷数越大离子半径越小;
B.同周期,从左向右第一电离能增大,同组元素自上而下,第一电离能逐渐减小;
C.F是电负性最强的元素,同周期自左到右,电负性逐渐增强;
D.非金属性越强,气态氢化物越稳定.
解答 解:A.S2-、Cl-、Ca2+离子电子层结构相同,核电荷数越大离子半径越小,故离子半径:S2->Cl->Ca2+,故A错误;
B.同组元素自上而下,第一电离能逐渐减小,因此第一电离能C>Si,同周期,从左向右第一电离能增大,因此第一电离能N>C,所以第一电离:N>C>Si,故B错误;
C.F是电负性最强的元素,同周期自左到右,电负性逐渐增强,因此电负性F>S>Mg,故C正确;
D.因非金属性O>S>Si,所以热稳定性:SiH4<H2S<H2O,故D错误;
故选C.
点评 本题考查同主族、同周期元素性质的比较,为高频考点,把握规律性知识的应用为解答的关键,选项B为解答的难点和易错点,题目难度中等.

练习册系列答案
相关题目
9.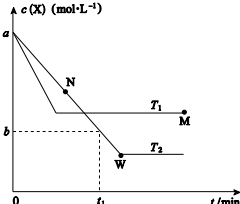 在恒容密闭容器中通入X 并发生反应:2X(g)?Y(g),温度T1、T2下X 的物质的量浓度c(X)随时间t 变化的曲线如图所示,下列叙述正确的是 ( )
在恒容密闭容器中通入X 并发生反应:2X(g)?Y(g),温度T1、T2下X 的物质的量浓度c(X)随时间t 变化的曲线如图所示,下列叙述正确的是 ( )
 在恒容密闭容器中通入X 并发生反应:2X(g)?Y(g),温度T1、T2下X 的物质的量浓度c(X)随时间t 变化的曲线如图所示,下列叙述正确的是 ( )
在恒容密闭容器中通入X 并发生反应:2X(g)?Y(g),温度T1、T2下X 的物质的量浓度c(X)随时间t 变化的曲线如图所示,下列叙述正确的是 ( )| A. | 该反应进行到M 点放出的热量大于进行到W 点放出的热量 | |
| B. | T2 下,在0~t1 时间内,v(Y)═$\frac{a-b}{{t}_{1}}$mol•L-1•min-1 | |
| C. | M 点的平衡常数小于W 点的平衡常数 | |
| D. | M 点时再加入一定量X,平衡后X 的转化率减小 |
14.下列过程中不属于氮的固定的是( )
| A. | 工业合成氨 | |
| B. | 雷雨天,空气中的氮气转化为能被植物吸收的硝酸盐 | |
| C. | 用氨气与硝酸制成“硝铵”化肥 | |
| D. | 豆科作物的根瘤菌将空气中的氮转化为氨 |
4.对于反应4NH3+5O2=4NO+6H2O,下列为四种不同情况下测得的反应速率(用v表示),其中能表明该反应进行最快的是( )
| A. | v (NH3)=0.2 mol/(L•s) | B. | v (O2)=1.4mol/(L•min) | ||
| C. | v (H2O)=0.25 mol/(L•s) | D. | v (NO)=9 mol/(L•min) |
11.某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )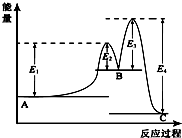

| A. | A?B的反应热△H=+(E2-E1)KJ/mol | |
| B. | 三种化合物中A最稳定 | |
| C. | C?B是放热反应 | |
| D. | 催化剂是要参与化学反应的,使用合适的催化剂可以降低反应所需要的活化能 |
9.体积为V mL、密度为ρ g•cm-3的溶液,含有相对分子质量为M的溶质m g,其物质的量浓度为c mol•L-1,溶质的质量分数为W%,下列表示式中不正确的是( )
| A. | c=$\frac{W1000ρ}{M}$ | B. | m=$\frac{VρW}{100}$ | C. | W%=$\frac{CM}{1000ρ}$% | D. | c=$\frac{1000m}{VM}$ |