题目内容
14.用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐相互反应,符合离子方程式2H++SO32-=H2O+SO2↑的反应个数有( )| A. | 4个 | B. | 6个 | C. | 8个 | D. | 12个 |
分析 离子方程式为2H++SO32-═SO2↑+H2O,为强酸(或强酸的酸式盐)与可溶性亚硫酸盐反应生成可溶性盐、水、二氧化硫的反应,以此来解答.
解答 解:亚硫酸的钾盐、钠盐、钡盐中,BaSO3不溶于水,离子方程式中不能用SO32-表示,其余在溶液中均可用SO32-表示;
四种酸中,醋酸是弱酸,离子方程式中不能用H+表示,HNO3有强氧化性,与SO32-反应时生成SO42-,离子方程式也不符合,硫酸氢钠和硫酸氢钾在溶液中显强酸性与亚硫酸盐反应生成二氧化硫;
则符合2H++SO32-═SO2↑+H2O,存在亚硫酸钾、亚硫酸钠与硫酸、盐酸、硫酸氢钠、硫酸氢钾可组合出8个反应,且离子方程式相同,
故选C.
点评 本题考查离子反应的书写,为高频考点,把握离子反应中保留化学式的物质即可解答,注意硝酸具有强氧化性为解答的易错点,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
4.对于反应4NH3+5O2=4NO+6H2O,下列为四种不同情况下测得的反应速率(用v表示),其中能表明该反应进行最快的是( )
| A. | v (NH3)=0.2 mol/(L•s) | B. | v (O2)=1.4mol/(L•min) | ||
| C. | v (H2O)=0.25 mol/(L•s) | D. | v (NO)=9 mol/(L•min) |
5.下列说法中正确的是( )
| A. | NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8e-稳定结构 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28′ | |
| C. | NaCl晶体中与每个Na+距离相等且最近Na+共有12个 | |
| D. | CsCl晶体中与每个Cs+距离相等且最近Cl-共有6个 |
2.下列关于硫及其化合物的说法中正确的是( )
| A. | 自然界中不存在游离态的硫,且S可溶于CS2 | |
| B. | SO2和SO3都是酸性氧化物,二者的水溶液都是强酸 | |
| C. | 浓硫酸可用来干燥SO2、CO、Cl2等气体 | |
| D. | 将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化 |
9.体积为V mL、密度为ρ g•cm-3的溶液,含有相对分子质量为M的溶质m g,其物质的量浓度为c mol•L-1,溶质的质量分数为W%,下列表示式中不正确的是( )
| A. | c=$\frac{W1000ρ}{M}$ | B. | m=$\frac{VρW}{100}$ | C. | W%=$\frac{CM}{1000ρ}$% | D. | c=$\frac{1000m}{VM}$ |
19.某溶液中加入铝片有氢气产生,则该溶液中一定能大量共存的离子组是( )
| A. | Cl- NO3- Ba2+ Fe3+ | B. | SO42- S2- Al3+ Mg2+ | ||
| C. | Na+ K+ SO42- Cl- | D. | NH4+ Ba2+ Cl- HCO3- |
6.下列离子方程式书写正确的是( )
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 碳酸氢钠溶液中滴加氢氧化钠溶液:HCO3-+OH-═CO2+H2O | |
| D. | 过氧化钠与水的反应:2Na2O2+2H2O═4Na++4OH-+O2↑ |
3.下列有关化学用语表示正确的是( )
| A. | 质子数和中子数均为6的碳原子:${\;}_{6}^{6}C$ | |
| B. | 硫离子的结构示意图: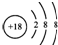 | |
| C. | 氢氧化钠的电子式: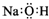 | |
| D. | 2-丙醇的结构简式: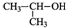 |
4.某高分子化合物的部分结构如图:关于该物质的下列说法中,正确的是( )
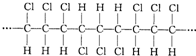

| A. | 合成该聚合物的单体是CHC1=CHC1 | |
| B. | 聚合物的链节(重复的基本结构单元)为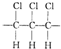 | |
| C. | 聚合物的分子式为C3H3C13 | |
| D. | 该聚合物可表示为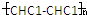 ,其中n为定值 ,其中n为定值 |