题目内容
20.将0.700g亚硫酸钠样品溶解在含0.00600mol硫酸标准溶液中,煮沸,冷却,加入指示剂,用0.1000mol/LNaOH标准溶液滴加至终点,消耗NaOH标准溶液20.00mL.该样品中亚硫酸钠的质量分数为90%.分析 先根据n=cV计算出消耗氢氧化钠的物质的量,再计算出氢氧化钠消耗硫酸的物质的量,从而可知亚硝酸钠消耗硫酸的物质的量,据此计算出亚硝酸钠的物质的量、质量,最后计算出样品中亚硝酸钠的质量分数.
解答 解:20.00mL 0.1000mol/L的氢氧化钠溶液中含有氢氧化钠的物质的量为:0.1000mol/L×0.02L=0.002mol,0.002molNaOH消耗硫酸的物质的量为:0.002mol×$\frac{1}{2}$=0.001mol,
则0.700g亚硝酸钠消耗硫酸的物质的量为:0.00600mol-0.001mol=0.005mol,
0.005mol硫酸能够消耗0.005mol亚硝酸钠,根据关系式Na2SO3~H2SO4可知,样品中含有亚硝酸钠的质量为:126g/mol×0.005mol=0.63g,
所以该样品中亚硝酸钠的质量分数为:$\frac{0.63g}{0.700g}$×100%=90%,
故答案为:90%.
点评 本题考查了根据化学方程式的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握关系式法在化学计算中的应用,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
10.某有机物的分子式为C5H10O,它能够发生银镜反应和加成反应,若将它与H2加成,所得产物结构简式可能是( )
| A. | (CH3)2CHCH(CH3)OH | B. | (CH3CH2)2CHOH | C. | CH3CH2C(CH3)2OH | D. | CH3(CH2)3CH2OH |
11.锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水.当生成2mol硝酸锌时,被还原的硝酸的物质的量为( )
| A. | 1mol | B. | 0.5mol | C. | 0.25 mol | D. | 0.125 mol |
8.下列物质中的杂质(括号内为杂质)的检验、除杂试剂或方法正确的是( )
| 选项 | 物质及杂质 | 检验 | 除杂试剂或方法 |
| A | I2(Cl2) | 湿润的淀粉-KI试纸 | NaI溶液 |
| B | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 | 过量CO2 |
| C | CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和Na2CO3溶液 |
| D | NO(NO2) | 观察颜色或湿润的淀粉-KI试纸 | 水 |
| A. | A | B. | B | C. | C | D. | D |
15.在无色透明的酸性溶液中,能大量共存的离子组是( )
| A. | Na+、K+、HCO3-、NO3- | B. | NH4+、Al3+、SO42-、NO3- | ||
| C. | K+、Fe2+、NH4+、NO3- | D. | NH4+、Na+、NO3-、OH- |
5.相同质量的下列物质分别与等浓度的NaOH溶液在烧杯中反应,至烧杯中恰好无固体物质时为止,消耗碱的量最少的是( )
| A. | Al | B. | Al(OH)3 | C. | AlCl3 | D. | Al2O3 |
12.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制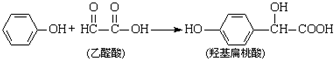
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 该反应是取代反应 | |
| B. | 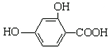 和羟基扁桃酸互为同系物 和羟基扁桃酸互为同系物 | |
| C. | 1个烃基扁桃酸分子中最多有17个原子共平面 | |
| D. | 1mol羟基扁桃酸分子最多能分别和1mol NaHCO3、2mol Na0H、3mol Na、4mol H2发生反应 |
17.下列说法正确的是( )
| A. | 热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的数据 | |
| B. | 升高温度或加入催化剂,不能改变化学反应的反应热 | |
| C. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 | |
| D. | 物质发生化学变化不一定伴随着能量变化 |