题目内容
18.某含有铝元素的翡翠的化学式为Be3Al2[Si6O18],其是一种多硅酸盐,Si原子采用的杂化类型为sp3杂化.分析 Be3Al2[Si6O18],根据在化合物中正负化合价代数和为零,硅元素显+4,根据价层电子对互斥理论确定Si原子采用的杂化类型,价层电子对个数=σ键个数+孤电子对个数,据此分析解答.
解答 解:根据在化合物中正负化合价代数和为零,铝元素显+3,铍元素显+2,氧元素显-2,设硅元素的化合价是x,可知Be3Al2(SiO3)6中铍元素的化合价:3×2+(+3)×2+(+x)×6+(-2)×18=0,则x=+4,硅元素显+4,SiO2中Si原子与O原子形成4个共价键,即含有4个σ电子对,硅原子无孤对电子,所以Si原子采用的杂化类型为sp3杂化,
故答案为:sp3杂化.
点评 本题考查了原子的杂化类型的判断,注意根据中心原子的价层电子对数分析,题目难度不大.

练习册系列答案
相关题目
6.钛号称“崛起的第三金属”,因具有密度小、强度大、无磁性等优良的机械性能,被广泛应用于军事、医学等领域.已知钛有48Ti、49Ti、50Ti等同位素,下列关于金属钛的叙述中不正确的是( )
| A. | 上述钛原子中,中子数不可能为22 | |
| B. | 钛元素在周期表中处于第四周期ⅡB族 | |
| C. | 钛原子的外围电子层排布为3d24s2 | |
| D. | 钛元素位于元素周期表的d区,是过渡元素 |
3.已知25℃时,有关弱酸的电离平衡常数如下表:
则等物质的量浓度的a.CH3COONa,b.NaCN,c.Na2CO3,d.NaHCO3溶液的pH由大到小的顺序是
c>b>d>a(填编号),0.18mol•L-1 CH3COONa的pH约为9.
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数Ka | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
c>b>d>a(填编号),0.18mol•L-1 CH3COONa的pH约为9.
10.下列与金属腐蚀有关的说法,正确的是( )
| A. | 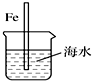 图中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. |  图中,发生吸氧腐蚀 | |
| C. | 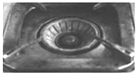 图中,燃烧灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 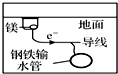 图中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁相当于原电池的正极 |
8.下列关于钠及其化合物的说法不正确的是( )
| A. | 钠与水反应放出氢气 | B. | 钠与水反应放出氧气 | ||
| C. | 实验室中钠常保存在煤油中 | D. | Na2O2 与水反应放出氧气 |