题目内容
10.下列实验对应的现象以及离子方程式不正确的是( )| 实验 | 现象 | 离子方程式 | |
| A | 向淀粉KI溶液中滴加硫酸氢钠溶液 | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2═2I2+2H2O |
| B | 将氯水滴加到含KSCN溶液的绿矾溶液中 | 溶液由浅绿色变为红色 | 2Fe2++Cl2═2Fe3++2Cl-, Fe3++3SCN-═Fe(SCN)3 |
| C | 向硫化钠和亚硫酸钠的混合液中滴加稀盐酸 | 产生淡黄色沉淀 | 2S2-+SO32-+6H+═3S↓+3H2O |
| D | 向含酚酞的氢氧化钡溶液中滴加稀硫酸 | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 A.发生氧化还原反应生成碘,遵循电子、电荷守恒;
B.亚铁离子被氧化,铁离子转化为络离子;
C.发生氧化还原反应生成S,遵循电子、电荷守恒;
D.不符合离子的配比.
解答 解:A.由现象可知,发生4H++4I-+O2═2I2+2H2O,碘遇淀粉变蓝,故A正确;
B.由现象可知,发生2Fe2++Cl2═2Fe3++2Cl-、Fe3++3SCN-═Fe(SCN)3,则溶液由浅绿色变为红色,故B正确;
C.由现象可知,发生2S2-+SO32-+6H+═3S↓+3H2O,故C正确;
D.由现象可知,发生Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故D错误;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,注意离子反应中保留化学式的物质、电子和电荷守恒及反应实质,题目难度不大.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
1.一定条件下,H2O2在水溶液中发生分解反应:2H2O2$\frac{\underline{\;一定条件\;}}{\;}$2H2O+O2↑.反应过程中,测得不同时间H2O2的物质的量浓度如下表所示:
(1)在H2O2分解反应中,氧化产物和还原产物的质量之比是8:9.
(2)在0-20min时间内,该反应的平均反应速率v(H2O2)=0.02mol/(L•min).
(3)若反应所用的H2O2溶液为100mL(忽略溶液体积的变化),则80min时,反应共产生O21.44g.
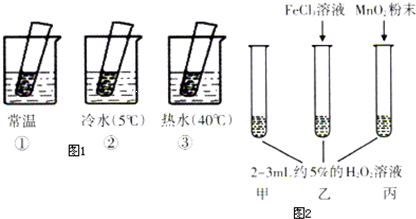
(4)如图1、图2是某学生探究外界条件对H2O2分解反应速率的影响实验装置示意图,请按表格要求填写空白.
实验一:(试管中均为滴有FeCl3溶液的5%H2O2溶液)
实验二:
| t/min | 0 | 20 | 40 | 60 | 80 |
| c(H2O2)/mol•L-1 | 1.0 | 0.60 | 0.40 | 0.20 | 0.10 |
(2)在0-20min时间内,该反应的平均反应速率v(H2O2)=0.02mol/(L•min).
(3)若反应所用的H2O2溶液为100mL(忽略溶液体积的变化),则80min时,反应共产生O21.44g.
(4)如图1、图2是某学生探究外界条件对H2O2分解反应速率的影响实验装置示意图,请按表格要求填写空白.
实验一:(试管中均为滴有FeCl3溶液的5%H2O2溶液)
| 现象 | 结论 | |
| 热水中 | 溶液中有气泡产生,比常温快 | 升高温度,H2O2的分解速率加快 |
| 常温中 | 溶液中有气泡产生,且速度较快 | 无 |
| 冷水中 | 溶液中有气泡产生,比常温慢 | 降低温度,H2O2的分解速率减慢 |
| 现象 | 结论 | |
| 丙加入MnO2 | MnO2能加快化学反应速率 | |
| 乙加入FeCl3 | FeCl3能加快化学反应速率 | |
| 甲不加其他试剂 | 溶液中有少量气泡出现 | 不使用催化剂化学反应速率较小 |

18.X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
请回答下列问题:
(1)W位于周期表中第三周期,第ⅦA族;
(2)X可形成双原子分子,其分子的电子式是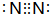 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.
| X | Y | |
| Z | W |
(1)W位于周期表中第三周期,第ⅦA族;
(2)X可形成双原子分子,其分子的电子式是
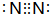 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.
5.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 500℃左右比室温更有利于合成氨的反应(△H<0) | |
| C. | 红棕色的NO2加压后颜色先变深再变浅(2 NO2?N2O4(无色)) | |
| D. | 光照新制的氯水时,溶液的pH逐渐减小 |
20.若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是( )
| A. | NH4+,NO3-,CO32-,Na+ | B. | Na+,Ba2+,Mg2+,HCO3- | ||
| C. | NO3-,Ca2+,K+,H+ | D. | NO3-,K+,AlO2-,OH- |
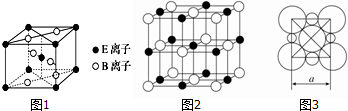
 ,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.
,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.