题目内容
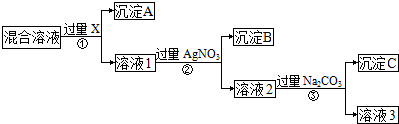
19.NH3与NO2是常见的氮的化合物,研究它们的综合利用有重要意义.(1)NO2产生的环境问题有产生光化学烟雾或形成酸雨(填一种).
(2)热电厂通常用NH3消除燃煤烟气中NO2,写出该反应化学方程式8NH3+6NO2=7N2+12H2O.
(3)氨气与氯化氢气体混合的现象是产生白烟,该反应可用于检验氨气或氯化氢是否泄漏.
(4)若将少量氨气与过量氯气混合,则生成一种酸性气体和另一种化合物A,A中所有原子均满足8电子稳定结构,试写出A的电子式
 ,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.
,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.
分析 (1)根据含氮化合物对环境的影响来回答,氮氧化物是污染性气体,容易形成光化学烟雾;
(2)氨气具有还原性,NO2具有强氧化性,二氧化氮氧化氨气生成氮气和水;
(3)氨气与氯化氢气体混合反应生成白色固体氯化铵,反应现象冒白烟,依据此现象可以检验氨气或氯化氢是否泄漏;
(4)若将少量氨气与过量氯气混合,则生成一种酸和另一种化合物A,A中所有原子均满足8电子稳定结构,生成的酸是HClO,A为NCl3,三氯化氮和水反应生成次氯酸和氨气.
解答 解:(1)氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,故答案为:产生光化学烟雾或形成酸雨;
(2)氨气具有还原性,NO2具有强氧化性,二氧化氮氧化氨气生成氮气和水,反应的化学方程式为:8NH3+6NO2=7N2+12H2O,
故答案为:8NH3+6NO2=7N2+12H2O;
(3)氨气与氯化氢气体混合反应生成白色固体氯化铵,NH3+HCl=NH4Cl,反应现象产生白烟,依据此现象可以检验氨气或氯化氢是否泄漏,
故答案为:产生白烟,检验氨气或氯化氢是否泄漏;
(4)若将少量氨气与过量氯气混合,则生成一种酸和另一种化合物A,A中所有原子均满足8电子稳定结构,生成的酸是HClO,A为NCl3,电子式为 ,三氯化氮和水反应生成次氯酸和氨气,反应方程式为NCl3+3H2O=NH3+3HClO,
,三氯化氮和水反应生成次氯酸和氨气,反应方程式为NCl3+3H2O=NH3+3HClO,
故答案为: ;NCl3+3H2O=NH3+3HClO.
;NCl3+3H2O=NH3+3HClO.
点评 本题考查氨气和氯气性质,侧重考查学生分析推断能力,知道氨气的检验方法及现象,掌握物质性质是解题关键,题目难度不大.

练习册系列答案
相关题目
11.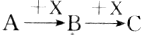 已知A、B、C三种物质有如图所示的转化关系(反应可在溶液中进行),其中A与C在一定条件下也能发生反应,则A不可能是( )
已知A、B、C三种物质有如图所示的转化关系(反应可在溶液中进行),其中A与C在一定条件下也能发生反应,则A不可能是( )
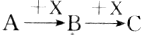 已知A、B、C三种物质有如图所示的转化关系(反应可在溶液中进行),其中A与C在一定条件下也能发生反应,则A不可能是( )
已知A、B、C三种物质有如图所示的转化关系(反应可在溶液中进行),其中A与C在一定条件下也能发生反应,则A不可能是( )| A. | SiO2 | B. | CH3CH2OH | C. | AlCl3 | D. | Cl2 |
10.下列实验对应的现象以及离子方程式不正确的是( )
| 实验 | 现象 | 离子方程式 | |
| A | 向淀粉KI溶液中滴加硫酸氢钠溶液 | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2═2I2+2H2O |
| B | 将氯水滴加到含KSCN溶液的绿矾溶液中 | 溶液由浅绿色变为红色 | 2Fe2++Cl2═2Fe3++2Cl-, Fe3++3SCN-═Fe(SCN)3 |
| C | 向硫化钠和亚硫酸钠的混合液中滴加稀盐酸 | 产生淡黄色沉淀 | 2S2-+SO32-+6H+═3S↓+3H2O |
| D | 向含酚酞的氢氧化钡溶液中滴加稀硫酸 | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
7.下列有关物质制备的反应中,其原理不属于氧化还原反应的是( )
| A. | 工业制粗硅 | B. | 湿法炼铜 | ||
| C. | 用稀盐酸与石灰石反应制取CO2 | D. | 稀硫酸与锌粒反应制取氢气 |
4.为了除去FeSO4溶液中的Fe2(SO4)3和CuSO4,最好选用的试剂是( )
| A. | 烧碱溶液 | B. | 浓氨水 | C. | 铁粉 | D. | 硫酸 |