题目内容
19.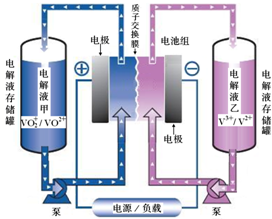 (1)全钒液流电池储能技术及应用荣获2015年国家技术发明二等奖.其结构及工作原理如图所示,电解液均呈酸性.
(1)全钒液流电池储能技术及应用荣获2015年国家技术发明二等奖.其结构及工作原理如图所示,电解液均呈酸性.①该电池放电时,正极反应为VO2++2H++e-═VO2++H2O,充电的总反应方程式为V3++VO2++H2O=VO2++2H++V2+.
②用该电池做电源,电解精炼铜,当外电路中通过1mol电子时,通过质子交换膜的n(H+)=1mol,析出铜的质量为32g.
(2)已知25℃时三种酸的电离常数如表所示:
| 化学式 | 电离常数 |
| HCN | K=6.2×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
②在0.5mol•L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的9×108倍.
分析 (1)①放电时正极发生还原反应;充电时,阴极反应为还原反应,故为V3+得电子生成V2+的反应;
②当转移1mol电子时,阳极(左槽)产生了2mol H+,而槽中间的交换膜只允许H+通过,所以有1mol H+移动到右槽(溶液中有离子移动才能形成闭合回路),所以最终左槽H+增加了1mol H+;,电极反应电子守恒计算析出铜的质量.
(2)①根据酸的电离常数进行分析判断,电离常数越大,对应盐的水解程度越小,溶液的pH越小;
②0.5mol/L 的醋酸电离出的c(H+)=$\sqrt{cKa}$=$\sqrt{1.8×1{0}^{-3}×0.5mol/L}$,利用Kw来计算水电离产生的氢离子浓度,然后比较即可.
解答 解:(1)①正极反应是还原反应,由电池总反应可知放电时的正极反应为VO2++2H++e-═VO2++H2O,充电时,阴极反应为还原反应,故为V3+得电子生成V2+的反应,电极方程式为V3++e-═V2+,充电时,阳极发生VO2++H2O=VO2++2H++e-,反应的总方程式为:V3++VO2++H2O=VO2++2H++V2+,
故答案为:VO2++2H++e-═VO2++H2O;V3++VO2++H2O=VO2++2H++V2+;
②当转移1mol电子时,阳极(左槽)产生了2mol H+,而槽中间的交换膜只允许H+通过,所以有1mol H+移动到右槽(溶液中有离子移动才能形成闭合回路),所以最终左槽H+增加了1mol H+,所以变化量为1mol,Cu2++2e-=Cu,析出铜物质的量0.5mol,质量=0.5mol×64g/mol=32g,
故答案为:1mol;32;
(2)①根据图表数据分析,电离常数:醋酸>HCN>碳酸氢根离子,所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的pH为:Na2CO3>NaCN>CH3COONa;
故答案为:Na2CO3>NaCN>CH3COONa;
②0.5mol/L 的醋酸电离出的c(H+)的电离平衡为CH3COOH?CH3COO-+H+,电离平衡常数计算为:$\frac{{c}^{2}({H}^{+})}{0.5-c({H}^{+})}$=1.8×10-5,0.5mol/L 的醋酸电离出的c(H+)=$\sqrt{cKa}$=$\sqrt{1.8×1{0}^{-3}×0.5mol/L}$≈3×10-3mol/L,水电离出的氢离子浓度c(H+)=c(OH-)=$\frac{Kw}{c({H}^{+})}$=$\frac{1{0}^{-14}}{3×1{0}^{-3}}$,则由HAC电离出的c(H+)约为水电离出的c(H+)倍数为:$\frac{3×1{0}^{-3}}{\frac{1}{3}×1{0}^{-11}}$=9×108,在0.5mol•L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的9×108倍,故答案为:9×108.
点评 本题考查盐类水解的应用,溶液酸碱性和pH的计算判断,溶液中离子浓度的大小比较,综合性较强,题目难度中等.

| A. | 石墨 | B. | 水晶 | C. | 不锈钢 | D. | 陶瓷 |
二氧化硫生成,原混合气体中硫化氢的体积是( )
| A. | 6ml | B. | 12ml | C. | 15ml | D. | 18ml |
| A. |  酒精 | B. |  浓盐酸 | C. |  浓硫酸 | D. |  CO2 |
| A. | 溴水 | B. | KMnO4溶液 | C. | 酒精 | D. | 水 |
| A. | 核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子” | |
| B. | 核外电子数为偶数的基态原子,其原子轨道中可能不含“未成对电子” | |
| C. | 核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子” | |
| D. | 核外电子数为奇数的基态原子,其原子轨道中一定不含“未成对电子” |
| A. | 表面积完全相同的锌片分别与同浓度、同体积的盐酸、硫酸在相同温度下反应 | |
| B. | 100℃时,向A、B两个容器中分别加入0.2mol的HI发生分解反应 | |
| C. | 同温下,分别向盛有等浓度的100mL、200mL盐酸的两个烧杯中加入表面积相同的石灰石 | |
| D. | 0.5mol•L-1的NaHCO3溶液分别与1mol•L-1盐酸和0.5mol•L-1硫酸混合 |
| A. | 它们的分子数目之比为1:1 | B. | 它们的氧原子数目之比为4:5 | ||
| C. | 它们的体积之比为5:4 | D. | 它们所含的硫原子数之比为5:4 |

| A. | 纯净物与混合物属于包含关系 | |
| B. | 化合物与单质属于包含关系 | |
| C. | 金属氧化物与酸性氧化物属于交叉关系 | |
| D. | 电解质与非金属氧化物属于并列关系 |