题目内容
10.等质量的SO2和SO3相比较,下列正确的是( )| A. | 它们的分子数目之比为1:1 | B. | 它们的氧原子数目之比为4:5 | ||
| C. | 它们的体积之比为5:4 | D. | 它们所含的硫原子数之比为5:4 |
分析 结合m=nM、V=nVm、N=nNA及分子构成计算.
解答 解:等质量的SO2和SO3的物质的量比为$\frac{m}{64}$:$\frac{m}{80}$=5:4,则
A.由N=nNA可知它们的分子数目之比为5:4,故A错误;
B.它们的氧原子数目之比为5×2:4×3=5:6,故B错误;
C.由V=nVm可知,温度、压强未知,Vm未知,不能计算体积之比,故C错误;
D.它们所含的硫原子数之比为5×1:4×1=5:4,故D正确;
故选D.
点评 本题考查物质的量的计算,为高频考点,把握质量、体积、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意物质的构成,选项C为易错点,题目难度不大.

练习册系列答案
相关题目
18.下列物质属于强电解质的是( )
| A. | H2O | B. | CO2 | C. | CH3COOH | D. | CH3COONa |
19.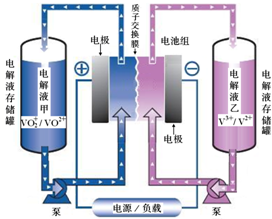 (1)全钒液流电池储能技术及应用荣获2015年国家技术发明二等奖.其结构及工作原理如图所示,电解液均呈酸性.
(1)全钒液流电池储能技术及应用荣获2015年国家技术发明二等奖.其结构及工作原理如图所示,电解液均呈酸性.
①该电池放电时,正极反应为VO2++2H++e-═VO2++H2O,充电的总反应方程式为V3++VO2++H2O=VO2++2H++V2+.
②用该电池做电源,电解精炼铜,当外电路中通过1mol电子时,通过质子交换膜的n(H+)=1mol,析出铜的质量为32g.
(2)已知25℃时三种酸的电离常数如表所示:
①等浓度的NaCN溶液、CH3COONa溶液和Na2CO3溶液,溶液的pH由大到小的顺序为:Na2CO3>NaCN>CH3COONa(填化学式).
②在0.5mol•L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的9×108倍.
 (1)全钒液流电池储能技术及应用荣获2015年国家技术发明二等奖.其结构及工作原理如图所示,电解液均呈酸性.
(1)全钒液流电池储能技术及应用荣获2015年国家技术发明二等奖.其结构及工作原理如图所示,电解液均呈酸性.①该电池放电时,正极反应为VO2++2H++e-═VO2++H2O,充电的总反应方程式为V3++VO2++H2O=VO2++2H++V2+.
②用该电池做电源,电解精炼铜,当外电路中通过1mol电子时,通过质子交换膜的n(H+)=1mol,析出铜的质量为32g.
(2)已知25℃时三种酸的电离常数如表所示:
| 化学式 | 电离常数 |
| HCN | K=6.2×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
②在0.5mol•L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的9×108倍.
16.下列解释事实的反应方程式正确的是( )
| A. | 亚硫酸钠水溶液显碱性:SO32-+2H2O?H2SO3+2OH- | |
| B. | SO2的水溶液显酸性:SO2+H2O?H2SO3?2H++SO32- | |
| C. | 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2 | |
| D. | 浓硫酸处理少量氨气:H2SO4+2NH3═(NH4)2SO4 |
2.某有机物结构简式为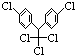 ,有关它的说法正确的是( )
,有关它的说法正确的是( )
 ,有关它的说法正确的是( )
,有关它的说法正确的是( )| A. | 它属于芳香烃 | B. | 分子中最多有23个原子共面 | ||
| C. | 分子式为C14H8Cl5 | D. | 1 mol该物质能与6 molH2加成 |
19.下列叙述正确的是( )
| A. | 强电解质溶液的导电能力一定比弱电解质溶液强 | |
| B. | 用相同的盐酸中和体积,物质的量浓度均相同的氢氧化钠和氨水溶液,所需盐酸的量相等 | |
| C. | 将氢氧化钠和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的50% | |
| D. | 氢氧化钠溶液的物质的量浓度是氨水的两倍,则氢氧化钠的OH-浓度也是氨水溶液的两倍 |





 、
、 、其最高价氧化物对应的水化物的化学式H3PO4、其气态氢化物的分子空间构型为三角锥形.
、其最高价氧化物对应的水化物的化学式H3PO4、其气态氢化物的分子空间构型为三角锥形.