题目内容
7.常用特定图案来表示危险化学品的类别.下列组合中图案与化学品性质相符的是( )| A. |  酒精 | B. |  浓盐酸 | C. |  浓硫酸 | D. |  CO2 |
分析 A、酒精易燃烧;
B、浓盐酸无强氧化性;
C、浓硫酸是酸具有腐蚀性;
D、二氧化碳不是液体.
解答 解:A.氢气易燃烧,是易燃液体,不是气体,故A错误;
B.浓盐酸无强氧化性,浓盐酸是酸,具有腐蚀性,故B错误;
C.浓硫酸是酸,强氧化性酸,具有腐蚀性,是腐蚀品,故C正确;
D.二氧化碳不是液体,是气体,故D错误;
故选C.
点评 本题通过化学药品名称与警示标志说明是否一致考查相关物质的性质,题目难度不大,平时注意相关物质基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列物质属于强电解质的是( )
| A. | H2O | B. | CO2 | C. | CH3COOH | D. | CH3COONa |
15.下列说法正确的是( )
| A. | 常温下,浓硫酸可以用铁制槽罐存放,说明铁与浓硫酸不反应 | |
| B. | 检验氯化氢中是否混有氯气,可采用湿润的有色布条 | |
| C. | 镁在空气中燃烧只生成氧化镁 | |
| D. | 钠可以从硫酸铜溶液中置换出金属铜 |
2.1932年美国化学家鲍林首先提出了电负性的概念.电负性(用X表示)也是元素的一种重要性质,如表给出的是原子序数小于20的16种元素的电负性数值:
请仔细分析,回答下列有关问题:
(1)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是:自上而下电负性降低;
(2)预测周期表中电负性最大的元素应为F(写元素符号);估计钙元素的电负性的取值范围:0.8<X<1.2.
(3)简述元素电负性X的大小与元素金属性、非金属性之间的关系非金属性越强电负性越大,金属性越强电负性越小.
(4)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中形成的化学键的类型为共价键.
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
(1)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是:自上而下电负性降低;
(2)预测周期表中电负性最大的元素应为F(写元素符号);估计钙元素的电负性的取值范围:0.8<X<1.2.
(3)简述元素电负性X的大小与元素金属性、非金属性之间的关系非金属性越强电负性越大,金属性越强电负性越小.
(4)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中形成的化学键的类型为共价键.
19.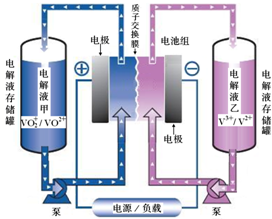 (1)全钒液流电池储能技术及应用荣获2015年国家技术发明二等奖.其结构及工作原理如图所示,电解液均呈酸性.
(1)全钒液流电池储能技术及应用荣获2015年国家技术发明二等奖.其结构及工作原理如图所示,电解液均呈酸性.
①该电池放电时,正极反应为VO2++2H++e-═VO2++H2O,充电的总反应方程式为V3++VO2++H2O=VO2++2H++V2+.
②用该电池做电源,电解精炼铜,当外电路中通过1mol电子时,通过质子交换膜的n(H+)=1mol,析出铜的质量为32g.
(2)已知25℃时三种酸的电离常数如表所示:
①等浓度的NaCN溶液、CH3COONa溶液和Na2CO3溶液,溶液的pH由大到小的顺序为:Na2CO3>NaCN>CH3COONa(填化学式).
②在0.5mol•L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的9×108倍.
 (1)全钒液流电池储能技术及应用荣获2015年国家技术发明二等奖.其结构及工作原理如图所示,电解液均呈酸性.
(1)全钒液流电池储能技术及应用荣获2015年国家技术发明二等奖.其结构及工作原理如图所示,电解液均呈酸性.①该电池放电时,正极反应为VO2++2H++e-═VO2++H2O,充电的总反应方程式为V3++VO2++H2O=VO2++2H++V2+.
②用该电池做电源,电解精炼铜,当外电路中通过1mol电子时,通过质子交换膜的n(H+)=1mol,析出铜的质量为32g.
(2)已知25℃时三种酸的电离常数如表所示:
| 化学式 | 电离常数 |
| HCN | K=6.2×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
②在0.5mol•L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的9×108倍.
16.下列解释事实的反应方程式正确的是( )
| A. | 亚硫酸钠水溶液显碱性:SO32-+2H2O?H2SO3+2OH- | |
| B. | SO2的水溶液显酸性:SO2+H2O?H2SO3?2H++SO32- | |
| C. | 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2 | |
| D. | 浓硫酸处理少量氨气:H2SO4+2NH3═(NH4)2SO4 |
19.下列叙述正确的是( )
| A. | 强电解质溶液的导电能力一定比弱电解质溶液强 | |
| B. | 用相同的盐酸中和体积,物质的量浓度均相同的氢氧化钠和氨水溶液,所需盐酸的量相等 | |
| C. | 将氢氧化钠和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的50% | |
| D. | 氢氧化钠溶液的物质的量浓度是氨水的两倍,则氢氧化钠的OH-浓度也是氨水溶液的两倍 |