题目内容
18.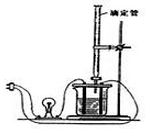 利用如图装置做下面的实验:在烧杯里盛半杯0.1mol/L乙溶液,然后用滴定管向容器里滴入0.1mol/L甲溶液.随着甲的滴入,电灯渐渐变暗亮,滴到一定量后,继续滴入甲溶液,电灯又会逐渐变暗.下列各组溶液中(甲在前,乙在后),能够产生上述现象的是( )
利用如图装置做下面的实验:在烧杯里盛半杯0.1mol/L乙溶液,然后用滴定管向容器里滴入0.1mol/L甲溶液.随着甲的滴入,电灯渐渐变暗亮,滴到一定量后,继续滴入甲溶液,电灯又会逐渐变暗.下列各组溶液中(甲在前,乙在后),能够产生上述现象的是( )| A. | NH3•H2O、AgNO3 | B. | CH3COOH、NH3•H2O | C. | NaOH、AlCl3 | D. | H2SO4、Ba(OH)2 |
分析 溶液的导电性与溶液中离子的浓度有关,离子浓度越大,溶液导电性越强,灯泡越亮,随着甲的滴入,电灯渐渐变暗亮,滴到一定量后,继续滴入甲溶液,电灯又会逐渐变暗,说明溶液中离子浓度先增大后减小,据此分析.
解答 解:A.向AgNO3中滴加NH3•H2O,一开始生成沉淀,电灯渐渐变暗暗,后来沉淀溶解生成银氨溶液,电灯又渐渐变暗亮,故A错误;
B.向NH3•H2O中滴加CH3COOH,生成醋酸铵强电解质,溶液中离子浓度增大,电灯渐渐变暗亮,滴到一定量后,继续滴入甲溶液,离子浓度减小,电灯又会逐渐变暗,故B正确;
C.向AlCl3中滴加NaOH,一开始生成沉淀,电灯渐渐变暗暗,后来沉淀溶解生成偏铝酸钠溶液,电灯又渐渐变暗亮,故C错误;
D.向Ba(OH)2中滴加H2SO4,一开始生成沉淀,电灯渐渐变暗暗,后来硫酸过量时,电灯又渐渐变暗亮,故D错误.
故选B.
点评 本题考查了溶液的导电性,题目难度不大,侧重于考查学生的分析能力和对基础知识的应用能力,注意把握影响溶液导电性的因素.

练习册系列答案
相关题目
8.下列离子方程式书写正确的是( )
| A. | NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,4OH-+3SO2═SO32-+2HSO3-+H2O | |
| B. | 碳酸氢镁中加过量氢氧化钠:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| D. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
9.在盛有硫酸铜饱和溶液的烧杯中,投入一块不规则的硫酸铜晶体,隔一段时间后,得到的结论是( )
| A. | 晶体部分溶解了 | |
| B. | 晶体形状和质量不变 | |
| C. | 晶体的质量增加了,形状也发生了改变 | |
| D. | 晶体的质量不变,形状改变了 |
13.下列说法不正确的是( )
| A. | 0.1mol/L的Na2CO3溶液加适量水稀释后,溶液中$\frac{c(O{H}^{-})}{c(C{O}_{3}^{2-})}$变大 | |
| B. | 若使Na2S溶液中$\frac{c(N{a}^{+})}{c({S}^{2-})}$接近于2:1,可加入适量的KOH固体 | |
| C. | 0.1mol/LNaOH溶液和0.2mol/LCH3COOH溶液等体积混合后溶液中各离子浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 已知0.1mol/L NaH2PO4水溶液显酸性,则溶液里各种离子浓度由大到小的顺序是c(Na+)>c(H2PO4-)>c(HPO42-)>c(H+)>c(PO43-)>c(OH-) |
3.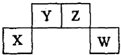 短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )
 短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )| A. | 常温下X的单质投入浓硫酸中没有明显现象 | |
| B. | Y的氢化物只有一种 | |
| C. | W的氧化物对应的水化物一定是强酸 | |
| D. | Z的氧化物排放不会造成环境污染 |
1.CuI是一种白色不溶于水的固体,以石墨(阴)和铜(阳)为电极组成电解槽,以含酚酞和淀粉的KI水溶液为电解液进行电解.电解开始不久,阴极区溶液显红色,而阳极区仍为无色.过了相当长的时间后,阳极区才呈蓝色,则电解开始时的电极反应为( )
| A. | 阳极反应:Cu-2e-═Cu2+ 阴极反应:Cu2++2e-═Cu | |
| B. | 阳极反应:2Cu-2e-+2I-═2CuI 阴极反应:2H++2e-═H2↑ | |
| C. | 阳极反应:2I--2e-═I2 阴极反应:2H++2e-═H2↑ | |
| D. | 阳极反应:Cu-2e-═Cu2+ 阴极反应:2H++2e-═H2↑ |
2.下列有关化学反应表达正确的是( )
| A. | 实验室用液溴和苯在催化剂作用下制溴苯: | |
| B. | 蛋壳溶于食醋:CaCO3+CH3COOH=CH3COOCa+H2O+CO2↑ | |
| C. | 甲醛溶液中加入足量新制碱性Cu(OH)2悬浊液并加热HCHO+2 Cu(OH)2+NaOH$\stackrel{△}{→}$ HCOONa+Cu2O↓+3H2O | |
| D. | 向氯乙烷水溶液中加入氢氧化钠溶液共热:CH3CH2Cl+NaOH $→_{△}^{水}$ CH2=CH2+NaCl+H2O |