题目内容
6.A、B、C三种强电解质,它们在水中电离出的离子如表所示:| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO${\;}_{4}^{2-}$、OH- |
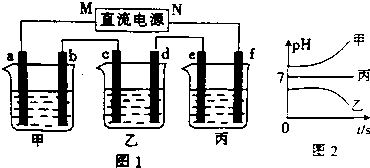
(1)电极b上发生的电极反应为4OH--4e-=2H2O+O2↑.
(2)写出乙烧杯的电解池总反应化学方程式2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4.
(3)用惰性电极电解B溶液,当阳离子浓度下降至一半时停止通电,加入下列物质不能使该溶液恢复至起始状态的是C.
A、CuO B、CuO C、Cu(OH)2 D、CuCO3
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行能(填“能”或“不能”).
(5)计算电极e上生成的气体在标准状态下的体积5.6L.
(6)要使丙烧杯溶液恢复到原来的状态,操作是向丙烧杯中加入4.5g水.
分析 测得乙中c电极质量增加了16g,则乙中含有Cu2+,结合离子的共存可知,B为CuSO4,丙中pH不变,则C为硫酸钠或硫酸钾,甲中pH增大,则A为KOH或NaOH,
(1)乙中c电极铜离子得电子,则c为阴极,即M为,电源负极,则b为阳极,碱溶液中OH-放电;
(2)乙烧杯中为惰性电极电解硫酸铜溶液;
(3)电解硫酸铜溶液,溶液中析出氧气和铜单质;
(4)铜离子电解完全后,溶液中氢离子继续电解;
(5)e电极上氢离子放电生成氢气,利用Cu~2e-~H2↑来计算;
(6)要使丙恢复到原来的状态,根据电解实质和生成产物,根据转移电子守恒计算.
解答 解:测得乙中c电极质量增加了16g,则乙中含有Cu2+,结合离子的共存可知,B为CuSO4,丙中pH不变,则C为硫酸钠或硫酸钾,甲中pH增大,则A为KOH或NaOH,
(1)乙中c电极铜离子得电子,则c为阴极,即M为电源负极,则b为阳极,碱溶液中OH-放电,电极反应为4OH--4e-=O2↑+2H2O,
故答案为:4OH--4e-=O2↑+2H2O;
(2)乙烧杯中为惰性电极电解硫酸铜溶液,总反应为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,
故答案为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4;
(3)电解硫酸铜溶液,溶液中析出氧气和铜单质,所以溶液中减小的元素是铜元素和氧元素,因此,可以加入CuO或CuCO3,不能加入Cu(OH)2,否则溶液中水的质量增大;
故答案为:C;
(4)铜离子电解完全后,溶液中氢离子继续电解,所以金属离子全部析出,此时电解能继续进行;
故答案为:能;
(5)e电极上氢离子放电生成氢气,n(Cu)=$\frac{16g}{64g/mol}$=0.25mol,由Cu~2e-~H2↑可知生成标况下氢气的体积为0.25mol×22.4L/mol=5.6L,
故答案为:5.6L;
(6)若经过一段时间后,测得乙中c电极质量增加了16g,要使乙恢复到原来的状态,根据电解反应2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,n(Cu)=$\frac{16g}{64g/mol}$=0.25mol,则转移电子为0.5mol;丙装置是电解水,依据电子守恒电解水的物质的量为0.25mol,加入水0.25mol×18g/mol=4.5g,恢复溶液浓度;
故答案为:向丙烧杯中加入4.5g水.
点评 本题考查电解原理的应用,明确发生的电极反应、电解反应及图象的分析是解答本题的关键,注意利用乙推出各物质及电源的正负极是解答的突破口,题目难度中等.

| A. | 白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 红热的铁丝与水接触表面形成蓝色保护层 | |
| D. | 在铁与稀H2SO4反应时,改用铁粉,可加快H2的产生 |
| A. | 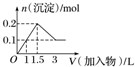 向1L浓度均为0.1 mol•L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol•L-1的稀H2SO4 | |
| B. | 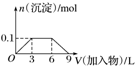 向1L浓度分别为0.1 mol•L-1和0.3 mol•L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol•L-1的稀NaOH溶液 | |
| C. | 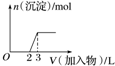 向烧碱溶液中滴加明矾溶液 | |
| D. |  向AlCl3溶液中滴加过量氨水 |
I.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,不断通入氯气至完全反应;
IV.加热蒸发、浓缩结晶,得到FeCl3•6H2O晶体.
(1)用FeCl3溶液腐蚀铜箔的离子方程式是Cu+2Fe3+=Cu2++2Fe2+,.
(2)试剂A是盐酸.
(3)步骤III反应过程中既有Fe2+又有Fe3+,如果要验证滤液中铁元素的存在形式,可另取反应过程中的两份滤液分别进行实验,实验方法、现象与结论如下表,请将其补充完整.可供选择的试剂:
a.酸性KMnO4 b.NaOH溶液 c.KSCN溶液 d.氯水
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液中加入c(填字母) | 液变成血红色 | 滤液中有Fe3+ |
| 步骤2:在滤液中加入a(填字母) | 紫红色褪去 | 滤液中有Fe2+ |
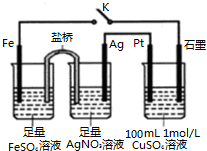
| A. | 盐桥中的电解质不可以用KCl | |
| B. | 闭合K,Pt电极上发生的反应为:4OH--4e-═O2↑+2H2O | |
| C. | 导线中流过0.5mol e-时,加入12.4g CuCO3,CuSO4溶液可恢复原组成 | |
| D. | 闭合K,整个电路中电流的流向为:Ag电极→Pt电极→石墨电极→Fe电极→Ag电极 |
| A. | 碳酸钠固体中含有碳酸氢钠固体,可用灼烧的方法 | |
| B. | 用酚酞溶液可以鉴别饱和食盐水和饱和纯碱溶液 | |
| C. | 25℃,碳酸氢钠在水中的溶解度比碳酸钠的大 | |
| D. | 氢氧化钠与二氧化碳的反应与量有关 |
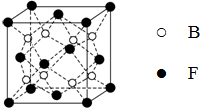 已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体. ,X的化学式Na3AlF6.
,X的化学式Na3AlF6.