题目内容
19.“绿色”净水剂高铁酸钾(K2FeO4)具有净水和消毒双重功能.(1)某学习小组设计如下方案制备高铁酸钾:
①在NaClO溶液中加入烧碱固体形成强碱性环境,将研磨过的硝酸铁少量多次地加入上述溶液中,冰水浴中反应1h,发生的离子反应为2Fe3++3ClO-+10OH-═2FeO42-+3Cl-+5H2O.氧化剂是NaClO,原料之一NaClO溶液本身呈碱(填:酸、碱或中)性.
②将KOH加入反应后的Na2FeO4溶液中搅拌半小时,静置,过滤得到粗产品晶体,该过程发生的反应的化学方程式为2KOH+Na2FeO4═K2FeO4+2NaOH.
(2)分析高铁酸钾中元素的化合价可推测它具有较强的氧化性.高铁酸钾和水反应生成物能吸附杂质净水,同时还产生气体,写出离子方程式4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-.
分析 (1)①反应2Fe3++3ClO-+10OH-═2FeO42-+3Cl-+5H2O中,次氯酸根中氯元素的化合价降低,所以氧化剂是NaClO,NaClO是强碱弱酸盐溶液水解呈碱性;
②根据复分解反应原理,反应的化学方程式为2KOH+Na2FeO4═K2FeO4+2NaOH;
(2)高铁酸钾中铁元素的化合价+6价,处高价态具有极强的氧化性,根据氧化还原反应电子得失守恒配平.
解答 解:(1)反应①2Fe3++3ClO-+10OH-═2FeO42-+3Cl-+5H2O中,次氯酸根中氯元素的化合价降低,所以氧化剂是NaClO,NaClO是强碱弱酸盐溶液水解呈碱性,故答案为:NaClO;碱;
②根据复分解反应原理,反应的化学方程式为2KOH+Na2FeO4═K2FeO4+2NaOH,故答案为:2KOH+Na2FeO4═K2FeO4+2NaOH;
(2)高铁酸钾中铁元素的化合价+6价,处高价态具有极强的氧化性,据电子得失守恒和质量守恒来配平,可得4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-,故答案为:氧化;4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-.
点评 本题结合高铁酸钾(K2FeO4)的制备主要考查了氧化还原反应的知识、盐溶液的酸碱性等,培养了学生运用知识的能力,题目难度中等.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
14.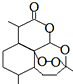 1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )
1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )
 1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )
1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )| A. | 青蒿素可以起取代反应 | B. | 青蒿素中的氧均为-2价 | ||
| C. | 青蒿素可以和NaOH溶液反应 | D. | 青蒿素的分子式为C15H22O5 |
11.据最新报道:用10B合成的10B20分子有非常好的抗癌作用.下列说法正确的是( )
| A. | 10B的质子数是10 | B. | 10B的中子数与核外电子数不同 | ||
| C. | 10B20是一种新合成的化合物 | D. | 10B20具有较强的化学活性 |
8.某同学在实验中不小心将几滴新制氯水滴入盛有溴化亚铁溶液的试剂瓶中,发现溶液变成了黄色,根据已有化学知识,请你参与上述现象形成原因的分析与探究:
(1)提出问题猜想:
猜想一:溶液呈黄色是因发生离子反应①2Fe2++Cl2=2Fe3++2Cl-(填离子方程式)所致.
猜想二:溶液呈黄色是因发生离子反应②2Br-+Cl2=Br2+2Cl-(填离子方程式)所致.
(2)设计实验并验证
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验.请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
(3)实验结论:以上实验不仅验证了溶液变黄的真实原因,同时证明了Fe2+的还原性比Br-强(填“强”或“弱”).
(4)实验反思
I.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是溶液分层,上层为黄色、下层为橙红色.
Ⅱ.在100mLFeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol/L.
(1)提出问题猜想:
猜想一:溶液呈黄色是因发生离子反应①2Fe2++Cl2=2Fe3++2Cl-(填离子方程式)所致.
猜想二:溶液呈黄色是因发生离子反应②2Br-+Cl2=Br2+2Cl-(填离子方程式)所致.
(2)设计实验并验证
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验.请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
| 试剂 | 酚酞试液、CCl4、无水酒精、KSCN溶液 | ||
| 方案 | 操作步骤 | 实验现象 | 结论 |
| 1 | 取所述黄色溶液于试管中,滴加KSCN溶液并振荡 | 溶液变红色 | 反应①所致 |
| 2 | 取所述黄色溶液于试管中,滴加CCl4并振荡 | 溶液分上下两层,上层为黄色、下层为无色 | |
(4)实验反思
I.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是溶液分层,上层为黄色、下层为橙红色.
Ⅱ.在100mLFeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol/L.
9.配制100mL 1mol/LNaOH溶液,下列说法正确的是( )
| A. | 在托盘天平两托盘上各放一片相同的纸,然后将NaOH放在纸片上进行称量 | |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| C. | 用蒸馏水洗涤烧杯、玻璃棒2-3次,洗涤液也移入容量瓶中 | |
| D. | 定容时俯视容量瓶的刻度线,会造成所配溶液物质的量浓度偏低 |
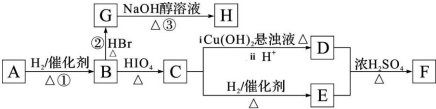
 .若H 分子中所有碳原子均在一条直线上,则G 转化为H 的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O.
.若H 分子中所有碳原子均在一条直线上,则G 转化为H 的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O. .
.
 .
.